Equilibrios en sistemas heterogéneos. Solubilidad de una sustancia. Producto de Solubilidad
De Wikillerato
| Línea 46: | Línea 46: | ||
== Grado de disociación== | == Grado de disociación== | ||
| - | == Solubilidad de una sustancia | + | == Solubilidad de una sustancia y Producto de solubilidad== |
| - | + | ||
| - | + | ||
[[Categoría: Química]] | [[Categoría: Química]] | ||
Revisión de 11:28 7 jul 2010
Equilibros heterogéneos
Los equilibrios heterogéneos a diferencia de los homogéneos (en estos todas las sustancias están en la misma fase) son aquellos en los cuales los reactivos y los productos están presenten en más de un fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido, gas o líquido.
En estos casos como regla general las concentraciones de los sólidos puros se pueden considerar prácticamente constantes mientras no se agoten, es decir mientras existan como sólidos en el equilibrio, por lo que no son incluidos en la constante de equilibrio. Por ello el valor de las concentraciones de los sólidos y de los líquidos puros se incluyen en la constante de equilibrio, en cuya expresión aparecen sólo las concentraciones de las sustancias disueltas en un medio líquido o gaseoso.
De la misma forma, en una reacción entre líquidos y gases, la concentración del vapor de las sustancias líquidas y gases, la concentración de vapor de las sustancias líquidas se puede considerar constante por lo que no aparecen en la expresión de la constante de equilibrio.
Si en la reacción intervienen sólidos  y líquidos
y líquidos  , en la expresión de la constante de equilibrio solo se incluyen los líquidos:
, en la expresión de la constante de equilibrio solo se incluyen los líquidos:
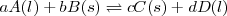 ;
;
![K_c = \frac{ [D]^{d} }{[A]^{a}} K_c = \frac{ [D]^{d} }{[A]^{a}}](/images/math/math-f210de3cef46b90d9e69a032c6f36744.png)
Si en la reacción intervienen gases y otros sólidos y/o líquidos puros, en la expresión de la constante de equilibrio solo intervienen los gases 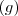 :
:
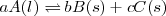 ;
;
![K_c ={[C]^{c}} K_c ={[C]^{c}}](/images/math/math-e5f2ff1feb19776ab29ecfaead610256.png)
Ejemplo:
La descomposición térmica del carbonato de calcio sólido (una reacción utilizada en la manufactura del cemento) sigue la reacción:
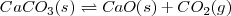
Cuando la reacción se lleva a cabo en un contenedor cerrado, tres fases son presentes en el equilibrio: el carbonato de calcio sólido, el óxido de calcio sólido y el dióxido de carbono gaseoso. Si se escribiera la constante de equilibrio de manera usual para esta reacción incluyendo todos los reactivos y todos los productos podríamos tener:
![�K_c� = \frac{ [CaO] [CO_2]}{[CaCO_3]}} �K_c� = \frac{ [CaO] [CO_2]}{[CaCO_3]}}](/images/math/math-d568137583acee62b7c0daae298c3098.png)
Pero debido a que 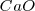 y
y 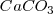 son sólidos puros, sus “concentraciones molares” son constantes. En general, la concentración de cualquier sólido puro (o cualquier líquido puro) es independiente de su cantidad debido a que su concentración es la razón (ratio) de su cantidad (en moles) a su volumen (en itros). Por ejemplo si se dobla la cantidad de carbonato cácico
son sólidos puros, sus “concentraciones molares” son constantes. En general, la concentración de cualquier sólido puro (o cualquier líquido puro) es independiente de su cantidad debido a que su concentración es la razón (ratio) de su cantidad (en moles) a su volumen (en itros). Por ejemplo si se dobla la cantidad de carbonato cácico 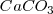 , también se dobla el volumen, pero la relación (ratio) de los dos (la concentración) permanece constante.
, también se dobla el volumen, pero la relación (ratio) de los dos (la concentración) permanece constante.
Si reordenamos la expresión anterior de la constante de equilibrio para la descomposición del carbonato cálcico se combinan las constantes ![[CaCO_3] [CaCO_3]](/images/math/math-0de7af89f3d868c35447350019b561e1.png) ,
, ![[CaCO] [CaCO]](/images/math/math-0570d800863749f18bfc73a9b149cad5.png) y
y 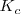 para obtener
para obtener
![�K_c� \frac{ [CaCO_3]} { [CaO]}} = [CO_2] �K_c� \frac{ [CaCO_3]} { [CaO]}} = [CO_2]](/images/math/math-cfbeb930705f837af3688ca2cb1c9439.png)
Así finalmente se puede escribir que la constante de equilibrio para la descomposición del carbonato cálcico es:
![K_c = [CO_2] K_c = [CO_2]](/images/math/math-41fb83c1c32b82b0f06a99d4b103d97d.png)
La ecuación de equilibrio análoga en término de la presión 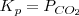
Para establecerse el equilibrio entre el carbonáto cácico sólido, el óxido de calcio sólido y le dióxido de carbono gaseoso todos los componentes deben estar presentes . Se sigue las ecuaciones para el equilibrio ![K_c = [CO_2] K_c = [CO_2]](/images/math/math-41fb83c1c32b82b0f06a99d4b103d97d.png) y
y 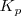 . No obstante, la concentración y la presión en el equilibrio del
. No obstante, la concentración y la presión en el equilibrio del 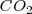 son constantes, independiente de cuanto
son constantes, independiente de cuanto 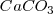 y
y 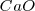 esté presente. Por otra parte si la temperatura es cambiada, la concentración y la presión del
esté presente. Por otra parte si la temperatura es cambiada, la concentración y la presión del 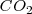 también cambia debido a que los valores de
también cambia debido a que los valores de 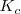 y
y 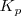 dependen de la temperatura.
dependen de la temperatura.



