Equilibrios en sistemas heterogéneos. Solubilidad de una sustancia. Producto de Solubilidad
De Wikillerato
Tabla de contenidos |
Equilibros heterogéneos
Los equilibrios heterogéneos a diferencia de los homogéneos (en estos todas las sustancias están en la misma fase) son aquellos en los cuales los reactivos y los productos están presenten en más de un fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido, gas o líquido.
En estos casos como regla general las concentraciones de los sólidos puros se pueden considerar prácticamente constantes mientras no se agoten, es decir mientras existan como sólidos en el equilibrio, por lo que no son incluidos en la constante de equilibrio. Por ello el valor de las concentraciones de los sólidos y de los líquidos puros se incluyen en la constante de equilibrio, en cuya expresión aparecen sólo las concentraciones de las sustancias disueltas en un medio líquido o gaseoso.
De la misma forma, en una reacción entre líquidos y gases, la concentración del vapor de las sustancias líquidas y gases, la concentración de vapor de las sustancias líquidas se puede considerar constante por lo que no aparecen en la expresión de la constante de equilibrio.
Si en la reacción intervienen sólidos  y líquidos
y líquidos  , en la expresión de la constante de equilibrio solo se incluyen los líquidos:
, en la expresión de la constante de equilibrio solo se incluyen los líquidos:
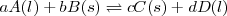 ;
;
![K_c = \frac{ [D]^{d} }{[A]^{a}} K_c = \frac{ [D]^{d} }{[A]^{a}}](/images/math/math-f210de3cef46b90d9e69a032c6f36744.png)
Si en la reacción intervienen gases y otros sólidos y/o líquidos puros, en la expresión de la constante de equilibrio solo intervienen los gases 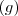 :
:
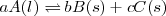 ;
;
![K_c ={[C]^{c}} K_c ={[C]^{c}}](/images/math/math-e5f2ff1feb19776ab29ecfaead610256.png)
Ejemplo:
La descomposición térmica del carbonato de calcio sólido (una reacción utilizada en la manufactura del cemento) sigue la reacción:
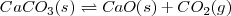
Cuando la reacción se lleva a cabo en un contenedor cerrado, tres fases son presentes en el equilibrio: el carbonato de calcio sólido, el óxido de calcio sólido y el dióxido de carbono gaseoso. Si se escribiera la constante de equilibrio de manera usual para esta reacción incluyendo todos los reactivos y todos los productos podríamos tener:
![�K_c� = \frac{ [CaO] [CO_2]}{[CaCO_3]}} �K_c� = \frac{ [CaO] [CO_2]}{[CaCO_3]}}](/images/math/math-d568137583acee62b7c0daae298c3098.png)
Pero debido a que 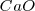 y
y 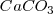 son sólidos puros, sus “concentraciones molares” son constantes. En general, la concentración de cualquier sólido puro (o cualquier líquido puro) es independiente de su cantidad debido a que su concentración es la razón (ratio) de su cantidad (en moles) a su volumen (en itros). Por ejemplo si se dobla la cantidad de carbonato cácico
son sólidos puros, sus “concentraciones molares” son constantes. En general, la concentración de cualquier sólido puro (o cualquier líquido puro) es independiente de su cantidad debido a que su concentración es la razón (ratio) de su cantidad (en moles) a su volumen (en itros). Por ejemplo si se dobla la cantidad de carbonato cácico 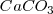 , también se dobla el volumen, pero la relación (ratio) de los dos (la concentración) permanece constante.
, también se dobla el volumen, pero la relación (ratio) de los dos (la concentración) permanece constante.
Si reordenamos la expresión anterior de la constante de equilibrio para la descomposición del carbonato cálcico se combinan las constantes ![[CaCO_3] [CaCO_3]](/images/math/math-0de7af89f3d868c35447350019b561e1.png) ,
, ![[CaCO] [CaCO]](/images/math/math-0570d800863749f18bfc73a9b149cad5.png) y
y 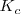 para obtener
para obtener
![�K_c� \frac{ [CaCO_3]} { [CaO]}} = [CO_2] �K_c� \frac{ [CaCO_3]} { [CaO]}} = [CO_2]](/images/math/math-cfbeb930705f837af3688ca2cb1c9439.png)
Así finalmente se puede escribir que la constante de equilibrio para la descomposición del carbonato cálcico es:
![K_c = [CO_2] K_c = [CO_2]](/images/math/math-41fb83c1c32b82b0f06a99d4b103d97d.png)
La ecuación de equilibrio análoga en término de la presión 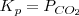
Para establecerse el equilibrio entre el carbonáto cácico sólido, el óxido de calcio sólido y le dióxido de carbono gaseoso todos los componentes deben estar presentes . Se sigue las ecuaciones para el equilibrio ![K_c = [CO_2] K_c = [CO_2]](/images/math/math-41fb83c1c32b82b0f06a99d4b103d97d.png) y
y 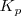 . No obstante, la concentración y la presión en el equilibrio del
. No obstante, la concentración y la presión en el equilibrio del 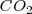 son constantes, independiente de cuanto
son constantes, independiente de cuanto 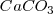 y
y 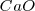 esté presente. Por otra parte si la temperatura es cambiada, la concentración y la presión del
esté presente. Por otra parte si la temperatura es cambiada, la concentración y la presión del 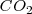 también cambia debido a que los valores de
también cambia debido a que los valores de 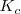 y
y 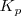 dependen de la temperatura.
dependen de la temperatura.
Grado de disociación
Solubilidad
La solubilidad de una sustancia es una cuantificación de la capacidad de una determinada sustancia para disolverse en otra. Puede expresarse de diferentes maneras: en moles por litro 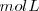 o moles por decímetro cúbico
o moles por decímetro cúbico 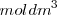 , en gramos por litro
, en gramos por litro 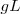 , o en porcentaje
, o en porcentaje  de soluto. La sustancia que se disuelve se denomina soluto y la sustancia donde se disuelve el soluto se llama solvente. Una solución está compuesta por un solvente y un soluto disuelto en aquel.
de soluto. La sustancia que se disuelve se denomina soluto y la sustancia donde se disuelve el soluto se llama solvente. Una solución está compuesta por un solvente y un soluto disuelto en aquel.
Se dice que un sistema aislado está en equilibrio cuando sus propiedades, en particular la distribución de los componentes entre las fases permanece constante con el paso del tiempo. Si el sistema en equilibrio contiene una solución y otra fase que es uno de los componentes de la solución en forma de sustancia pura, la concentración de aquella sustancia en la solución es llamada solubilidad de la sustancia. La solución se dice que es una solución saturada.
Producto de solubilidad
Consideremos una disolución saturada de la sal 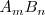 en la que la parte disuelta se encuentra ionizada. Existe un equilibrio entre la parte que queda sin disolver y los iones disueltos:
en la que la parte disuelta se encuentra ionizada. Existe un equilibrio entre la parte que queda sin disolver y los iones disueltos:
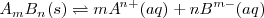
La constante de equilibrio es:
![\frac{ [A^{n+}]^{m} [B^{m-}]^{n} }{[A_m [B_n] (s)}} \frac{ [A^{n+}]^{m} [B^{m-}]^{n} }{[A_m [B_n] (s)}}](/images/math/math-f2e301f3d15723d6dd759116eeaa3933.png)
Como la disolución está saturada, la concentración de la fase sólida correspondiente a la sal sin disolver permanece constante, por lo que se puede incluir en la constante de equilibrio. Luego:
Esta constante 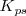 que depende de la temperatura (como las demás contantes) , se denomina producto de solubilidad. Normalmente se refiere a la temperatura estándar de 25 ºC (298K)
que depende de la temperatura (como las demás contantes) , se denomina producto de solubilidad. Normalmente se refiere a la temperatura estándar de 25 ºC (298K)
La solubilidad es la concentración de la disolución saturada en el equilibrio:
Sustituyendo en la constante del producto de solubilidad, resulta:
![K_{ps} = [A^{n+}]^m [B^m]^n = (mS)^m (nS)^n =m^mN^nS^{m-n} K_{ps} = [A^{n+}]^m [B^m]^n = (mS)^m (nS)^n =m^mN^nS^{m-n}](/images/math/math-c20041c8238b42d1cf8ae3dd37a5bd1b.png) y de ahí
y de ahí
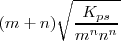
Expresión que relaciona la solubilidad de una sal poco soluble con la constante del producto de solubilidad
Por ejemplo:
A 0 ºC un solución de borax conteniedndo 1.3 gramos (g) de tetraborato de sodio anhidro 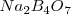 , en 100 g de agua esta en equilibrio con la fase solida
, en 100 g de agua esta en equilibrio con la fase solida 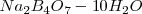 (tretaborato de sodio decahidratado) permaneciendo la composición de la solución constante. La solubilidad de
(tretaborato de sodio decahidratado) permaneciendo la composición de la solución constante. La solubilidad de 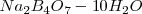 en agua es por lo tanto de 1.3 g de
en agua es por lo tanto de 1.3 g de 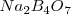 por 100 g, o, corrigiendo para la hidratación del agua, 2,5 g de
por 100 g, o, corrigiendo para la hidratación del agua, 2,5 g de 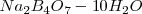 por 100 g.
por 100 g.
La solubilidad del cloruro de plata 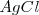 a 25 ºC (298K) es de
a 25 ºC (298K) es de 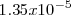 . Cuando
. Cuando 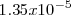 moles
moles 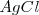 se disulven en
se disulven en 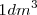 se forman
se forman 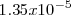 de iones
de iones 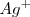 y
y 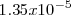 de iones
de iones 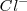 y ambos tienen una solubilidad de
y ambos tienen una solubilidad de 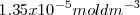
El producto de solubilidad es dado por la ecuación:
![K_{ps} = [Ag^+] [Cl^-]= (1.35 x 10^{-5}) (1.35 x 10^{-5}) = 1.82 x 10^{-10} K_{ps} = [Ag^+] [Cl^-]= (1.35 x 10^{-5}) (1.35 x 10^{-5}) = 1.82 x 10^{-10}](/images/math/math-2e7021376f06fb300ca80d7aec3c007e.png)
El hidróxido de hierro (II) tiene una solubilidad en agua de 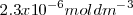 a 298K. La disolución de un mol de
a 298K. La disolución de un mol de 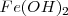 produce un mol de iones
produce un mol de iones 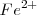 y dos moles de iones hidróxido
y dos moles de iones hidróxido 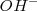 según la ecuación:
según la ecuación:
![Fe(OH)_2 (s) \rightleftharpoons Fe{2+} (aq) + 2 [OH^-] (aq) Fe(OH)_2 (s) \rightleftharpoons Fe{2+} (aq) + 2 [OH^-] (aq)](/images/math/math-afbf00c353d7f71e550e94e8ff1ec0a1.png)
A la temperatura de 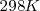 en una solución saturada de <mathFe(OH)_2 </math> la concentración de iones
en una solución saturada de <mathFe(OH)_2 </math> la concentración de iones 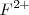 es igual a la solubilidad de la sal
es igual a la solubilidad de la sal 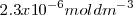 , pero la contración de iones hidróxido
, pero la contración de iones hidróxido 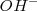 es el doble de esta cantidad (
es el doble de esta cantidad (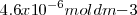 .
.
El producto de solubilidad para este equilibrio es:
![K_{ps}= [Fe{2+}] [OH^- ]^2 = (2.3 x 10^{-6}) (4.6 x 10^{-6}) =4.9 x 10^{-17} K_{ps}= [Fe{2+}] [OH^- ]^2 = (2.3 x 10^{-6}) (4.6 x 10^{-6}) =4.9 x 10^{-17}](/images/math/math-f25fcee76f6af5fbd839b072d52a36d3.png)


![K_{ps} = [A^{n+}]^m [B^{m-}]^n K_{ps} = [A^{n+}]^m [B^{m-}]^n](/images/math/math-997650a1b0af9bd3db9e4d8fd3d367fb.png)
![S= [A_mB_n (ac)] = \frac {[A^{n+}]} {m}= \frac {[B^{m-}]} {n} S= [A_mB_n (ac)] = \frac {[A^{n+}]} {m}= \frac {[B^{m-}]} {n}](/images/math/math-e68dac9a8987ee9a57d1a559890fd59f.png)

