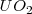Redes cristalinas
De Wikillerato
Redes iónicas
Los sólidos iónicos están formados como disposiciones espaciales de iones que se repiten con regularidad a lo largo de las tres coordenadas del espacio. Estas ordenaciones materiales, cuya estructura se puede determinar con difracción de rayos X, se denominan redes iónicas o redes cristalinas.
La disposición que adoptarán los iones en el espacio de la red será aquella que determine un mínimo de energía potencial electrostática del conjunto de la red. Este mínimo de energía se alcanza teniendo en cuenta los siguientes factores:
A) Los iones del mismo signo estarán lo más separados posibles.
B) Los iones de distinto signo estarán lo más cerca posible.
C) Los volúmenes de los iones son prácticamente inalterables debido al efecto de repulsión entre las capas electrónicas de los distintos átomos.
D) El conjunto tienen que tener neutralidad eléctrica (como nos dice la fórmula unidad) Ejemplos de redes iónicas sencilla:
- Red de cloruro de sodio, (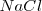 )
)
Es una red iónica formada por los iones 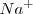 y los iones
y los iones 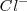 . El radio del ión cloruro es, más o menos, el doble que el ión sodio, de modo que alrededor de cada cloro podrían alojarse 12 iones sodio, pero cada sodio solo puede rodearse de 6 iones de cloro. La eletroneutralidad de la formula empírica (unidad) exige que ambos electrones estén en la proporción 1:1. Por lo tanto la red es un empaquetamiento cúbico de aniones con todos sus huecos octaédricos ocupados por cationes sodio. Cáda ión sodio está equidistante de cada uno de los seis iones cloro y cada ión cloro está rodeado por seis iones sodio. Todos los cationes como los aniones tienen el mismo número de coordinación, 6. Otros compuestos iónicos que forman este tipo de red se encuentran bromuro de sodio,
. El radio del ión cloruro es, más o menos, el doble que el ión sodio, de modo que alrededor de cada cloro podrían alojarse 12 iones sodio, pero cada sodio solo puede rodearse de 6 iones de cloro. La eletroneutralidad de la formula empírica (unidad) exige que ambos electrones estén en la proporción 1:1. Por lo tanto la red es un empaquetamiento cúbico de aniones con todos sus huecos octaédricos ocupados por cationes sodio. Cáda ión sodio está equidistante de cada uno de los seis iones cloro y cada ión cloro está rodeado por seis iones sodio. Todos los cationes como los aniones tienen el mismo número de coordinación, 6. Otros compuestos iónicos que forman este tipo de red se encuentran bromuro de sodio, 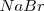 , óxido de magnesio
, óxido de magnesio 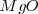 y óxido de calcio
y óxido de calcio 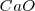 .
.
- Red de cloruro de cesio, (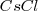 )
)
El átomo de 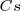 en la tabla periódica nos indica que el catión
en la tabla periódica nos indica que el catión 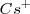 es bastante más grande que la del ión
es bastante más grande que la del ión 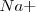 , de modo que puede coordinar un mayor número que este. El cristal de la sal de cloruro de cesio es la red modelo de las redes constituidas por un empaquetamiento simple de aniones, con todos los huecos de simetria cúbica ocupados por cationes. Alrededor del un ión cesio se disponen 8 iones cloruro. Dado que la carga eléctrica del ion
, de modo que puede coordinar un mayor número que este. El cristal de la sal de cloruro de cesio es la red modelo de las redes constituidas por un empaquetamiento simple de aniones, con todos los huecos de simetria cúbica ocupados por cationes. Alrededor del un ión cesio se disponen 8 iones cloruro. Dado que la carga eléctrica del ion 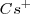 es la misma, en valor absoluto, que la del ión
es la misma, en valor absoluto, que la del ión 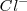 , el número de coordinación de ambos será similar, es decir 8.
, el número de coordinación de ambos será similar, es decir 8.
La red del cloruro de cesio la adoptan también otros compuestos iónicos como 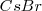 ,
, 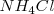
- Red de fluorita, 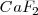
En este caso la carga de los dos iones 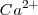 y el
y el 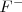 es distinta, por lo que el número de coordinación no puede ser el mismo en los dos. De hecho el ión calcio tiene el doble de índice de coordinación que el ión floruro, 8 para el primero y 4 para el segundo. La fluorita tiene por ello una estructura de empaquetamiento compacto de cationes con sus huecos tetraédricos cerrados por aniones. Otos compuestos iónicos que asumen este tipo de red son
es distinta, por lo que el número de coordinación no puede ser el mismo en los dos. De hecho el ión calcio tiene el doble de índice de coordinación que el ión floruro, 8 para el primero y 4 para el segundo. La fluorita tiene por ello una estructura de empaquetamiento compacto de cationes con sus huecos tetraédricos cerrados por aniones. Otos compuestos iónicos que asumen este tipo de red son 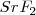 ,
, 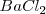 y
y