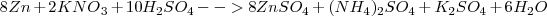Reacciones de oxidación-reducción. Ajuste estequiométrico
De Wikillerato
Ajuste estequiométrico de reacciones redox
Introducción
sdgggsno en el reaccionante es absorbido añadiendo agua al primer miembro, que pasa al segundo miembro como iones 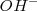 . Si hay defecto de oxígeno en algún reaccionante, se añade al primer miembreo iones
. Si hay defecto de oxígeno en algún reaccionante, se añade al primer miembreo iones 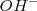 , que proporcionarán el oxígeno necesario y se transformará en agua, que aparecerá en el segundo miembro.
, que proporcionarán el oxígeno necesario y se transformará en agua, que aparecerá en el segundo miembro.
3.- Se ajustan los átomos de cada semireacción, se procede al ajuste eléctrico añadiendo los electrones que corresponda en el miembro pertinente de cada semireacción.
4.- Hay que igualar los electrones producidos en la semireacción de oxidación con los consumidos en la de reducción, por el mismo procedimiento del mínimo común múltiplo.
5.- Se suman las semireacciones, se eliminan términos comunes en ambos miembros de la reacción global, y ya se tiene la reacción ajustada.
Ejemplo:
El ión nitrato reacciona en medio ácido con el cinc metálico para dar ión amonio e ión cinc. El ajuste de esta reacción redox se realizaría por el método de ión-electrón de la siguiente manera:
1.- Las semireacciones de este proceso redox son:
Oxidación: 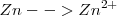 (el número de oxidación –nox- pasa de 0 a 2+)
(el número de oxidación –nox- pasa de 0 a 2+)
Reducción: 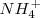 ( el nox del N pasa de +5 a -3)
( el nox del N pasa de +5 a -3)
2. Ajuste atómico: El Zn no necesita nada, ya que está ajustado. El nitrato pierde oxígeno, que al estar en medio ácido será capturado por iones 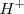 para formar moléculas de agua (
para formar moléculas de agua (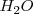 ). Por lo tanto, las semireacciones quedan atómicamente ajustadas así:
). Por lo tanto, las semireacciones quedan atómicamente ajustadas así:
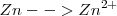

3. Se realiza el ajuste eléctrico para conservar la carga:
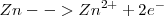
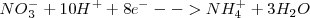
4.- Igualación de lo electrones de ambas semireacciones:
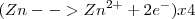
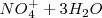
5.- Suma de semireacciones y eliminación de términos comunes (en este caso, solo los electrones):
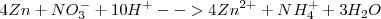
La reacción iónica que es la más importante la tenemos ya ajustada.
Para ajustar la reacción molecular en la que se expresa ya no solo los iones participantes, sino los compuestos reales que los contienen y con los que se preparan las disoluciones, se emplean los siguientes criterios:
Para pasar de la ecuación iónica a la molecular, lo iones hidrógeno pueden ser sustituidos por ácido sulfúrico (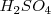 , y los iones hidróxido por hidróxido de sodio
, y los iones hidróxido por hidróxido de sodio 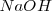 o hidroxido de potasio
o hidroxido de potasio 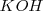 . Los cationes pueden parecer como sulfatos y los aniones como sales de sodio o potasio.
. Los cationes pueden parecer como sulfatos y los aniones como sales de sodio o potasio.
La ecuación iónica anterior se ajustaría molecularmente de la siguiente manera:
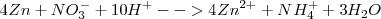
Lo diez protones 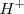 los aportan diez moléculas de ácido sulfúrico con el nitrato siendo de potasio (
los aportan diez moléculas de ácido sulfúrico con el nitrato siendo de potasio (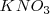 ) :
) :
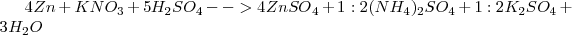
El ajuste no es incompatible con el empleo de coeficientes fraccionarios (e.g 1/2 , representado en la ecuación anterior como 1:2) , y que estos se pueden eliminar multiplicando los dos miembros de la ecuación por el mismo número natural.
Así en este caso, multiplicando por dos desaparecen los coeficientes fraccionarios:
Y la ecuación redox está ajustada iónicamente y molecularmente.
Tweet