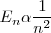Postulados de Bohr
De Wikillerato
| (Una edición intermedia no se muestra.) | |||
| Línea 1: | Línea 1: | ||
| - | El físico danes Niels H. D. Bohr (1885-1962) propuso un modelo en 1913 publicado en la revista ''Philosophical Magazine'' para el átomo de hidrógeno en el que combinaba el trabajo de Planck, Einstein y Rutherford y que | + | El físico danes Niels H. D. Bohr (1885-1962) propuso un modelo en 1913 publicado en la revista ''Philosophical Magazine'' para el átomo de hidrógeno en el que combinaba el trabajo de Planck, Einstein y Rutherford y que tuvo un éxito muy destacado en predecir el ciertas características del [[espectro de hidrógeno]] observadas experimentalmente. |
<h4>Antecedentes históricos a la propuesta de Bohr</h4> | <h4>Antecedentes históricos a la propuesta de Bohr</h4> | ||
| - | El ''modelo atómico planetario'' propuesto en 1911 por el físico neozelandés Ernest Rutherford (1871-1937) en base a los experimentos de | + | El ''modelo atómico planetario'' propuesto en 1911 por el físico neozelandés Ernest Rutherford (1871-1937) en base a los experimentos de bombardeo de finas láminas de átomos de oro con partículas <math>\alpha</math> (núcleos de átomos de helio) que los científicos alemanes Hans W. Geiger (1882-1945) y sir Ernest Marsden (1889-1970) habían realizaron en bajo su dirección (entonces eran sus alumnos), suponía la existencia en el átomo de un '''núcleo''' de pequeño tamaño (~<math>10^{-14} m</math>) y volumen en relación con el resto del átomo completo (<math>10^{-10} m</math>) donde se concentra la mayoría de la masa atómica, estando cargado positivamente y con los electrones de carga negativa orbitando (girando) alrededor del mismo unidos por la atracción electrostática del núcleo, al igual que los planetas que orbitan alrededor del Sol. |
La mecánica clásica permitía un modelo de órbitas circulares y elípticas para el electrón en este modelo planetario. Por ejemplo, el átomo más sencillo de todos, el átomo de hidrógeno, constaría de un electrón y un núcleo positivo (con un protón) la carga del núcleo <math>+Ze</math> es la misma que la del electrón (<math>-e</math>) pero de signo contrario, por lo que el átomo es eléctricamente neutro. Este modelo planetario es estable mecánicamente, debido a que el potencial de Coulomb: | La mecánica clásica permitía un modelo de órbitas circulares y elípticas para el electrón en este modelo planetario. Por ejemplo, el átomo más sencillo de todos, el átomo de hidrógeno, constaría de un electrón y un núcleo positivo (con un protón) la carga del núcleo <math>+Ze</math> es la misma que la del electrón (<math>-e</math>) pero de signo contrario, por lo que el átomo es eléctricamente neutro. Este modelo planetario es estable mecánicamente, debido a que el potencial de Coulomb: | ||
Revisión actual
El físico danes Niels H. D. Bohr (1885-1962) propuso un modelo en 1913 publicado en la revista Philosophical Magazine para el átomo de hidrógeno en el que combinaba el trabajo de Planck, Einstein y Rutherford y que tuvo un éxito muy destacado en predecir el ciertas características del espectro de hidrógeno observadas experimentalmente.
Tabla de contenidos |
Antecedentes históricos a la propuesta de Bohr
El modelo atómico planetario propuesto en 1911 por el físico neozelandés Ernest Rutherford (1871-1937) en base a los experimentos de bombardeo de finas láminas de átomos de oro con partículas 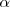 (núcleos de átomos de helio) que los científicos alemanes Hans W. Geiger (1882-1945) y sir Ernest Marsden (1889-1970) habían realizaron en bajo su dirección (entonces eran sus alumnos), suponía la existencia en el átomo de un núcleo de pequeño tamaño (~
(núcleos de átomos de helio) que los científicos alemanes Hans W. Geiger (1882-1945) y sir Ernest Marsden (1889-1970) habían realizaron en bajo su dirección (entonces eran sus alumnos), suponía la existencia en el átomo de un núcleo de pequeño tamaño (~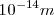 ) y volumen en relación con el resto del átomo completo (
) y volumen en relación con el resto del átomo completo (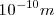 ) donde se concentra la mayoría de la masa atómica, estando cargado positivamente y con los electrones de carga negativa orbitando (girando) alrededor del mismo unidos por la atracción electrostática del núcleo, al igual que los planetas que orbitan alrededor del Sol.
) donde se concentra la mayoría de la masa atómica, estando cargado positivamente y con los electrones de carga negativa orbitando (girando) alrededor del mismo unidos por la atracción electrostática del núcleo, al igual que los planetas que orbitan alrededor del Sol.
La mecánica clásica permitía un modelo de órbitas circulares y elípticas para el electrón en este modelo planetario. Por ejemplo, el átomo más sencillo de todos, el átomo de hidrógeno, constaría de un electrón y un núcleo positivo (con un protón) la carga del núcleo 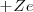 es la misma que la del electrón (
es la misma que la del electrón (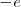 ) pero de signo contrario, por lo que el átomo es eléctricamente neutro. Este modelo planetario es estable mecánicamente, debido a que el potencial de Coulomb:
) pero de signo contrario, por lo que el átomo es eléctricamente neutro. Este modelo planetario es estable mecánicamente, debido a que el potencial de Coulomb:
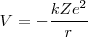
![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
proporciona la fuerza centrípeta:
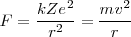
![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png)
necesaria para que el electrón se mueva en un circulo de radio  a una velocidad
a una velocidad  , siendo
, siendo 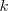 la constante de Coulomb. Pero es eléctricamente inestable debido a que el electrón está siempre acelerando hacia el centro del círculo. Las leyes de la electrodinámica clásica (ley de Larmor) predicen que una carga acelerando radia luz con una frecuencia igual al periodo del movimiento, en este caso la frecuencia de revolución
la constante de Coulomb. Pero es eléctricamente inestable debido a que el electrón está siempre acelerando hacia el centro del círculo. Las leyes de la electrodinámica clásica (ley de Larmor) predicen que una carga acelerando radia luz con una frecuencia igual al periodo del movimiento, en este caso la frecuencia de revolución  .
.
Así clasicamente tenemos que:
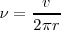 =
= 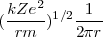 =
=
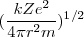 ·
· 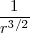 ~
~ 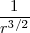
![[3] [3]](/images/math/math-5997f14afe377dff877df1d1629d9c02.png)
La energía total del electrón es la suma de las energías cinética y potencial:
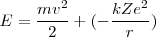
![[4] [4]](/images/math/math-b89757a59b41b6506218bd6647cd5ee7.png)
A partir de la ecuación ![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png) se tiene que
se tiene que
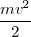 =
=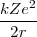
![[5] [5]](/images/math/math-311713d7e899562efc3b7c08c8a01ccb.png)
(un resultado que se mantiene para el movimiento circular [[1]] en un campo de fuerzas inversamente proporcional al cuadrado de la distancia), así que la energía total puede ser descrita como:
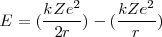 =
= 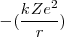 ~
~ 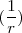
![[6] [6]](/images/math/math-efa651c624c49f90c998fb329daf1ea9.png)
Así, la física clásica predice que debido a que la energía es perdida por radiación el tamaño de la órbita del electrón alrededor del núcleo (dado por  ) se irá reduciendo cada vez más haciéndose cada vez más pequeña, incrementándose de igual manera la tasa en la cual la energía del electrón es perdida, el proceso que terminaría cuando el electrón alcanzara el núcleo, colapsando con el mismo. Este tiempo puede ser calculado por la mecánica y electrodinámica clásica y resultaría ser menos de un microsegundo. Así, el modelo planetario clásico para el átomo predice que este debería radiar un espectro continuo (ya que la frecuencia de revolución cambia continuamente cuando el electrón cae en espiral hacia el núcleo) y que se produciría un colapso cuando el electrón se precipitara contra el núcleo, un resultado que afortunadamente no ocurre. Es decir según este modelo el átomo es una entidad inestable, llamada a desaparecer con el tiempo. Experimentalmente se comprueba todo lo contrario que a no ser que el átomo sea excitado, el átomo no radia, no emite radiación electromagnética y que cuando es excitado el átomo radia una línea espectral discreta y no un espectro de radiación continua.
) se irá reduciendo cada vez más haciéndose cada vez más pequeña, incrementándose de igual manera la tasa en la cual la energía del electrón es perdida, el proceso que terminaría cuando el electrón alcanzara el núcleo, colapsando con el mismo. Este tiempo puede ser calculado por la mecánica y electrodinámica clásica y resultaría ser menos de un microsegundo. Así, el modelo planetario clásico para el átomo predice que este debería radiar un espectro continuo (ya que la frecuencia de revolución cambia continuamente cuando el electrón cae en espiral hacia el núcleo) y que se produciría un colapso cuando el electrón se precipitara contra el núcleo, un resultado que afortunadamente no ocurre. Es decir según este modelo el átomo es una entidad inestable, llamada a desaparecer con el tiempo. Experimentalmente se comprueba todo lo contrario que a no ser que el átomo sea excitado, el átomo no radia, no emite radiación electromagnética y que cuando es excitado el átomo radia una línea espectral discreta y no un espectro de radiación continua.
Para “solucionar” estas dificultades inabordables desde un punto de vista clásico, Bohr introdujo ad hoc en su modelo de 1913 una serie de postulados no clásicos de naturaleza cuántica, introduciendo con ello la cuantificación (cuantización) iniciada por Planck y Einstein en el “corazón” de la estructura del átomo.
Postulados del modelo atómico de Bohr
Primer postulado:
Los electrones se mueven en ciertas órbitas permitidas alrededor del núcleo sin emitir radiación. Así Bohr asumió que el átomo de hidrógeno puede existir solo en ciertos estados discretos, los cuales son denominados estados estacionarios del átomo. En el átomo no hay emisión de radiación electromagnética mientras el electrón no cambia de órbita.
Con este postulado Bohr evitaba el problema de la inestabiliad orbital eléctrica del electrón que predice la electrodinámica clásica y por tanto del átomo, al postular que la radiación de energía por parte de las partículas cargadas es válida a escala macroscópica pero no es aplicable al mundo microscópico del átomo, pero si esto es así surge el problema de de explicar la transición entre los estados estacionarios y la emisión de radiación por el átomo para ello Borh introdujo otro postulado :
Segundo postulado:
El átomo radia cuando el electrón hace una transición (“salto”) desde un estado estacionario a otro, es decir toda emisión o absorción de radiación entre un sistema atómico esta generada por la transición entre dos estados estacionarios. La radiación emitida (o absorbida) durante la transición corresponde a un cuanto de energía (fotón) cuya frecuencia  esta relacionada con las energías de las órbitas estacionarias por la ecuación de Planck:
esta relacionada con las energías de las órbitas estacionarias por la ecuación de Planck: 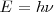
![[7] [7]](/images/math/math-c7e87f6a9b372fed3cdc993d50c13979.png) [[2]]
[[2]]
y está determinada por la relación :
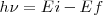
![[8] [8]](/images/math/math-041bd3d5f7775a49b25036b205a084f9.png)
donde 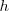 es la constante de Planck (
es la constante de Planck (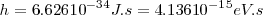 ), con
), con 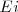 y
y 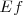 son las energías de los estados estacionarios iniciales y finales de la transición electrónica. La ecuación
son las energías de los estados estacionarios iniciales y finales de la transición electrónica. La ecuación ![[3] [3]](/images/math/math-5997f14afe377dff877df1d1629d9c02.png) es referida como la condición de frecuencia de Bohr.
es referida como la condición de frecuencia de Bohr.
Este postulado está basado en el concepto de fotón introducido por Einstein [[3]], junto con la conservación de la energía; si la luz está compuesta de fotones de energía , la emisión por parte del átomo de un fotón debe suponer una pérdida de energía igual a la energía del fotón emitido (o si es la absorción de un fotón a la ganancia de energía), por lo tanto es un postulado equivalente aquel de la conservación de la energía en la emisión del fotón, es crucial, debido a que con el Bohr se desvía “de la senda de la teoría clásica”, que requiere que la frecuencia de radiación sea igual a la frecuencia del movimiento de la partícula cargada. Así, mientras el equilibrio dinámico mecánico del sistema en los estados estacionarios está regido por las leyes ordinarias de la mecánica, sin embargo, dichas leyes no son aplicables cuando se trata de transiciones entre estados estacionarios.
Tercer postulado:
Las órbitas estacionarias admisibles son aquellas en las que el momento angular orbital 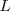 del electrón está cuantizado, pudiendo este asumir solamente valores múltiplos enteros de
del electrón está cuantizado, pudiendo este asumir solamente valores múltiplos enteros de 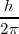 , donde
, donde 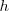 es la constante de Planck y
es la constante de Planck y  es un número integral (
es un número integral (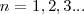 ), llamado numero cuántico principal. Así,
), llamado numero cuántico principal. Así,
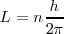
![[9] [9]](/images/math/math-9c181ce514a5b3b7448bf286d22938e4.png)
Este postulado Bohr introduce de nuevo la idea de cuantización en una nueva área de la física clásica al presuponer la idea de cuantización del momento angular orbital de un electrón que se mueve bajo la acción de una fuerza culombiana.
Órbitas y niveles energéticos electrónicos del átomo de Bohr
Utilizando estos postulado Bohr fue capaz de calcular el tamaño de las órbitas estacionarias y de la energía de esas órbitas, veamos como:
Teniendo en cuenta como habíamos visto anteriormente, si la carga nuclear es 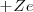 y la carga del electrón
y la carga del electrón 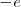 la fuerza centrípeta necesaría para mover el electrón en un órbita circular es proporcionada por la ley de Coulomb
la fuerza centrípeta necesaría para mover el electrón en un órbita circular es proporcionada por la ley de Coulomb
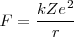
![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
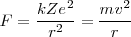
![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png)
despejando de esta ecuación ![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png) la velocidad orbital del electrón
la velocidad orbital del electrón  tenemos que:
tenemos que:
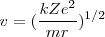
![[10] [10]](/images/math/math-72c6de23946c890c5f38892fa34fa37a.png)
La condición de cuantificación del momento angular orbital L de Bohr (tercer postulado) para el electrón es:
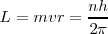 =
= 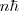
![[11] [11]](/images/math/math-d453df59240d501fbe009575ed8356a7.png)
la constante 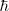 , llamada h barrada o constante de Planck reducida :
, llamada h barrada o constante de Planck reducida :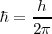 , es frecuentemente más conveniente utilizarla en vez de
, es frecuentemente más conveniente utilizarla en vez de 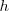 en los cálculos. Al igual que la frecuencia angular
en los cálculos. Al igual que la frecuencia angular 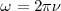 es frecuentemente más conveniente que
es frecuentemente más conveniente que  estando expresada en radianes por segundo (rad/s) en lugar de ciclos por segundo (Hz). Una frecuencia expresada en radianes por segundo es referida como una frecuencia angular por lo que la ecuación de Planck puede también expresarse como:
estando expresada en radianes por segundo (rad/s) en lugar de ciclos por segundo (Hz). Una frecuencia expresada en radianes por segundo es referida como una frecuencia angular por lo que la ecuación de Planck puede también expresarse como: 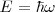
![[12] [12]](/images/math/math-907f0ce762f390b96813f2ec9e60155e.png)
La combinación de las ecuaciones y ![[11] [11]](/images/math/math-d453df59240d501fbe009575ed8356a7.png)
![[12] [12]](/images/math/math-907f0ce762f390b96813f2ec9e60155e.png) permite escribir:
permite escribir:
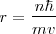 =
=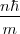
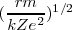
![[13] [13]](/images/math/math-611c5d8d5f4ce49a2c3254c31032c0a0.png)
Elevando al cuadrado los dos lados de la ecuación ![[13] [13]](/images/math/math-611c5d8d5f4ce49a2c3254c31032c0a0.png) tenemos:
tenemos:
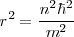
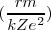
![[14] [14]](/images/math/math-ffa52789636c2dbc230d6429b89fd479.png)
Cancelando las cantidades comunes a ambos lados nos queda:
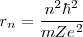 =
=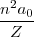
![[15] [15]](/images/math/math-49fc9186bccea8a052e9797c2dbff8c1.png)
donde 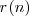 es el radio de la órbita electrónica que depende de
es el radio de la órbita electrónica que depende de  el número cuántico principal, y donde:
el número cuántico principal, y donde:
[16]
es el llamado radio de Bohr.
Las órbitas estacionarias de Bohr del primer postulado tienen radios de órbita cuantizados, denotado en la ecuación por 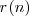 , El radio de Bohr corresponde al hidrógeno con un
, El radio de Bohr corresponde al hidrógeno con un 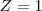 (el átomo de hidrógeno solo tiene un protón en el núcleo), y corresponde a un radio de órbita con
(el átomo de hidrógeno solo tiene un protón en el núcleo), y corresponde a un radio de órbita con 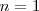 , la órbita posible más pequeña para el electrón en el átomo de hidrógeno. Ya que el tamaño de la órbita varia inverasmente con el valor de
, la órbita posible más pequeña para el electrón en el átomo de hidrógeno. Ya que el tamaño de la órbita varia inverasmente con el valor de 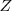 , las órbitas de Borh para átomos con un único electrón es tán más cercanas al núcelo que aquella del átomo de hidrógeno.
, las órbitas de Borh para átomos con un único electrón es tán más cercanas al núcelo que aquella del átomo de hidrógeno.
La energía total del electrón ![[ 5] [ 5]](/images/math/math-e1003ae418dd806b52d21a6827cb437e.png) se puede calcular después de la sustitución de
se puede calcular después de la sustitución de 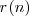 de la ecuación
de la ecuación ![[15] [15]](/images/math/math-49fc9186bccea8a052e9797c2dbff8c1.png) :
:
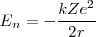 =
=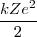
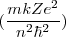
![[18] [18]](/images/math/math-823499ad2c8e307f36dcd3893d2f0943.png)
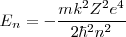 =
=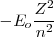 donde
donde 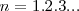
![[19] [19]](/images/math/math-56cf9437d10a93100320426f5abe723b.png)
donde 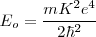
![[20] [20]](/images/math/math-7ba40b23641d11116c60bd65b0839176.png)
Así, la energía del electrón en las órbitas estacionarias está también cuantizada, i.e. Los estados estcionarios correspondes a valores específicos de la energía total.
Deducción de la formula de Rydberg-Ritz a partir del modelo de Bohr
Los datos espectrales del para el átomo de hidrógeno podían agruparse en series espectrales, obtenidas de la formula general obtenida por Rydberg-Ritz;
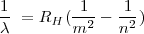
![[21] [21]](/images/math/math-7e0cd656fac7a7fc6267fefc0de23a9e.png)
donde 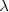 es la longitud de onda de la raya espectral,
es la longitud de onda de la raya espectral, 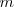 es es un numero entero que designa la serie,
es es un numero entero que designa la serie,  el término de la serie y
el término de la serie y 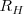 es la constante de Rydberg para el átomo de hidrógeno. Esta fórmula había sido obtenida por una vía totalmente empírica, y permanecia sin una justificación teórica. El modelo de de Bohr permitió deducir la expresión
es la constante de Rydberg para el átomo de hidrógeno. Esta fórmula había sido obtenida por una vía totalmente empírica, y permanecia sin una justificación teórica. El modelo de de Bohr permitió deducir la expresión ![[20] [20]](/images/math/math-7ba40b23641d11116c60bd65b0839176.png) de una manera simple como una consecuencia del modelo, veamos como:
de una manera simple como una consecuencia del modelo, veamos como:
Según el segundo postulado de Bohr la frecuencia de radiación emitida en la transición entre los estados iniciales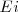 y
y 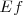 final valdrá:
final valdrá:
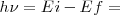
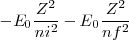
![[22] [22]](/images/math/math-4c3a95e06c3fe3f1f84744bdb07317fe.png)
o despejando 
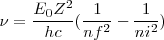
![[23] [23]](/images/math/math-3166a405d85008e5ec4c19f08f69042c.png)
que puede ser escrita en la forma de la fórmula de Rydberg-Ritz haciendo la sustitución 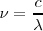 y dividiendo por
y dividiendo por  , la velocidad de la luz, para obtener:
, la velocidad de la luz, para obtener:
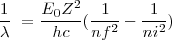
![[24] [24]](/images/math/math-d86f337c250cf771fb807617f7c0f63e.png)
o bien:
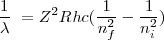
![[25] [25]](/images/math/math-733d9572f94a00c3e08abe349b6bc981.png)
donde 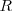
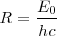 =
=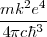
![[26] [26]](/images/math/math-187ef11b93ce26eea4a27d965d14f7a9.png)
es la predición que obtuvo teóricamente Bohr de la constante de Rydberg. Tomando los valores 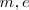 y
y 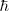 conocidos en 1913 el resultado obtenido estaba de acuerdo (dentro de los límites apropiados de incertidumbre de las constantes) con el valor experimentalmente obtenido con espectroscopia
conocidos en 1913 el resultado obtenido estaba de acuerdo (dentro de los límites apropiados de incertidumbre de las constantes) con el valor experimentalmente obtenido con espectroscopia
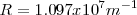
![[27] [27]](/images/math/math-a6efe38e808cd686010e3e5f7f4c8e9d.png)
Como podemos observar la ecuación ![[25] [25]](/images/math/math-733d9572f94a00c3e08abe349b6bc981.png) es idéntica a la ecuación
es idéntica a la ecuación ![[21] [21]](/images/math/math-7e0cd656fac7a7fc6267fefc0de23a9e.png) , con la sustitución
, con la sustitución 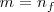 y
y 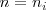 . Una ecuación empírica explicada por un modelo teórico. Todo un logro de la física teórica.
. Una ecuación empírica explicada por un modelo teórico. Todo un logro de la física teórica.
Los posibles valores de energía para el átomo de hidrógeno predichos por la ecuación obtenida del modelo de Bohr con 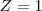 :
:
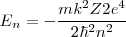 =
=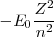
![[28] [28]](/images/math/math-bac494f40d1af217350f72b8c930a11e.png) donde
donde 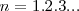
donde 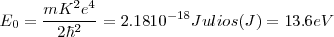
![[29] [29]](/images/math/math-f136824b8702f56ec8156ee908293a27.png)
O puesto en forma más concisa:
donde, 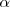 es la constante de proporcionalidad es igual a
es la constante de proporcionalidad es igual a 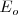 que es la magnitud de
que es la magnitud de 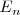 con
con 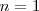 . El estado
. El estado 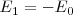 es llamado el estado fundamental, que corresponde así al estado de energía más baja del electrón en el átomo de hidrógeno. Los distintos niveles de energía pueden ser obtenidos sutituyendo
es llamado el estado fundamental, que corresponde así al estado de energía más baja del electrón en el átomo de hidrógeno. Los distintos niveles de energía pueden ser obtenidos sutituyendo  por los distintos valores de
por los distintos valores de 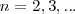 los niveles obtenidos así de energía pueden representarse en un diagrama de niveles de energía.
los niveles obtenidos así de energía pueden representarse en un diagrama de niveles de energía.
La energía del átomo de hidrógeno en el estado fundamental es pues -13.6 eV, electrón voltios. Esta energía es también la requerida para extraer un electrón del átomo, siendo por ella denominada energía de ionización o de enlace, del electrón en el átomo de hidrógeno.
Los procesos de emisión y de absorción de radiación pueden ahora entenderse con el modelo de Bohr en los siguientes términos. En ausencia de perturbaciones externas, los átomos permanecerán en el estado energético más bajo el estado fundamenta. Cuando sobre el átomo incide energía lumínica (e,g un haz de radiación policromática), este absorberá energía y el electrón efectuará una transición pasando a ocupar un nivel estacionario de energía superior o estado excitado. El electrón solo puede absorber cantidades discretas de energía, de tal manera que su estado final corresponderá a uno de los estados estacionarios definidos por la ecuación ![[28] [28]](/images/math/math-bac494f40d1af217350f72b8c930a11e.png) . Tras permanecer un tiempo excitado y de manera espontánea el átomo emitirá este exceso de energía dessxcitándose y realizando en consecuncia una transición “salto” a órbitas con niveles inferiores de energía, la frecuencia de la radiación emitida solo puede tomar un valor determinado, proporcional a la diferencia de energía de los niveles involucrados.
. Tras permanecer un tiempo excitado y de manera espontánea el átomo emitirá este exceso de energía dessxcitándose y realizando en consecuncia una transición “salto” a órbitas con niveles inferiores de energía, la frecuencia de la radiación emitida solo puede tomar un valor determinado, proporcional a la diferencia de energía de los niveles involucrados.
Así pues es fácil comprender ahora el origen de las series espectrales del átomo de hidrógeno, En la época que Bohr propuso su modelo se correspondia la serie de Balmer, correspondiente a 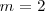 y
y 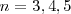 en la ecuación
en la ecuación ![[20] [20]](/images/math/math-7ba40b23641d11116c60bd65b0839176.png) y la serie de Paschen correspondiente a
y la serie de Paschen correspondiente a 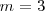 y
y 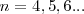 . En 1916 T. Lyman halló la serie correspondiente a
. En 1916 T. Lyman halló la serie correspondiente a 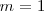 y en 1922 y 1924 F. Brackett y H.A. Pfund respectivamente hallaron las series correspondientes a
y en 1922 y 1924 F. Brackett y H.A. Pfund respectivamente hallaron las series correspondientes a 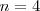 y
y 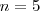 respectivamente. La seríe de Balmer se observa en la porción visible del espectro electromagnético; la serie de Lyman en el ultravioleta y las de Paschen, Brackett y Pfund en el infrarrojo.
respectivamente. La seríe de Balmer se observa en la porción visible del espectro electromagnético; la serie de Lyman en el ultravioleta y las de Paschen, Brackett y Pfund en el infrarrojo.
Fallos del modelo atómico de Bohr
El modelo de Bohr constituyó una etapa principal hacia el desarrollo de la teoría cuántica moderna del átomo, con una correcta descripción de la naturaleza de las órbitas del electrón. Pero, los postulados de Bohr son claramente son una mezcla de ideas de la física clásica con las ideas de cuantización introducidas inicialmente por Planck y Einstein. Por un lado el electrón se mueve en órbita circular y obedece a las ecuaciones de movimiento de la mecánica clásica, pero por otro una magnitud como el momento angular que en mecánica clasica puede tener un continuo de valores, en una órbita estacionaria permitida el electrón debe satisfacer una condición no clásica de cuantización del momemto angular orbital, el cual solo puede alcanzar una serie de valores discretos (una idea cuántica). Por otra parte el electrón estando en órbita obedece a una ley del electromagnetismo clásico que es la ley de coulomb, pero por el contrario, no cumple la ley clásica que garantizaría la radiación de energía por parte de una carga acelerada. En definitiva estos postulados establece que las leyes físicas clásicas que son válidas para los sistemas a escala macroscópica deja de serlo en el mundo de los sistemas microscóspicos.
Pronto se evidenciaron algunos de los defectos del modelo de Bohr pues:
El modelo falla para proporcionar una explicación de porque ciertas lineas espectrales en el espectro del hidrógeno son más brillantes que otras, esto es no proporcionaba una manera satisfactoria para poder calcular la probabilidad de transición de un estado cuántico a otro. Es decir, el modelo no tiene ningún mecanismo para calcular las probabilidades de transición entre estados estacionarios.
El modelo de Bohr trata al electrón como si fuera un planeta en miniatura, con un radio definido de órbita y de momento. Este supuesto es una directa violación del principio de incertidumbre, un principio clave la la Mecánica Cuántica el cual dicta que el mundo cuántico la posición y el momento no pueden ser simultáneamente determinado.
El modelo de Bohr proporciona un modelo conceptual básico de órbitas de electrones y energías. Los detalles del espectro y la distribución de carga requiere de los cálculos de la mecánica cuántica que utilizan la ecuación de Schrödinger.
No obstante, Bohr introdujo un importante principio llamado principio de correspondencia que afirma que en el límite de las grandes órbitas y energías (en la región de números cuánticos grandes e.g.  ) los cálculos cuánticos deben estar de acuerdo con los cálculos clásicos o en otras palabras si se realizan modificaciones de la física clásica para describir el mundo submicroscópico cuando los resultadosde estos sean extendidos al mundo macroscópico, los resultados deben estar de acuerdo con las leyes clásicas de la física que han sido verificadas en la escala ordinaria del mundo de cada día.
) los cálculos cuánticos deben estar de acuerdo con los cálculos clásicos o en otras palabras si se realizan modificaciones de la física clásica para describir el mundo submicroscópico cuando los resultadosde estos sean extendidos al mundo macroscópico, los resultados deben estar de acuerdo con las leyes clásicas de la física que han sido verificadas en la escala ordinaria del mundo de cada día.
Aunque los detalles del modelo atómico de Bohr han sido han sido suplantados por la moderna mecánica cuántica, su condición de frecuencia y el principio de correspondencia permanecen todavía como un rasgo esencial de la nueva teoría cuántica.
Referencias
Niels Bohr. La teoría atómica y la descripción de la Naturaleza.Alianza Editorial.1988. Un libro esencial para comprender el pensamiento de uno de los fundadores y más influyentes científicos de la física moderna.
Paul. A.Tipler & Ralph A. Lewellyn. Modern Physics. W. H. Freeman Company. New Tork, Third Edition.1999. Un clásico de los libros de texto de física moderna.
Enlaces externos
Artículo original de Bohr de 1913 publicado en la revista Philosophical Magazine en inglés:[[4]]
Hyperphysics: Bohr Model [[5]]
Animaciones externas
Series espectrales del átomo de hidrógeno: [[6]] [[7]]. Magnífica animación de las transiciones electrónicas que dan lugar a las distinas series espectrales (Lyman, Balmer, Paschen, Brackett) del espectro del átomo de hidrógeno.
Tweet