Noción de orbital atómico: números cuánticos
De Wikillerato
(Diferencias entre revisiones)
| (4 ediciones intermedias no se muestran.) | |||
| Línea 9: | Línea 9: | ||
<TR><TH>''m''<TD>Magnetico<TD>Momento magnetico del orbital (orientacion)<TD>-l, -l+1,..0, ...l-1, +l | <TR><TH>''m''<TD>Magnetico<TD>Momento magnetico del orbital (orientacion)<TD>-l, -l+1,..0, ...l-1, +l | ||
<TR><TH>''s''<TD>Spin<TD> Spin electronico<TD> +1/2 o -1/2 | <TR><TH>''s''<TD>Spin<TD> Spin electronico<TD> +1/2 o -1/2 | ||
| + | |||
| + | [[Categoría:Física]] | ||
Revisión actual
Cada orbital atomico es definido por tres numeros cuanticos: 'n l m. Los electrones son definidos por cuatro numeros cuanticos: n l m s. Los tres primeros definen el orbital en que se encuentra el electron. s es el numero conocido como spin. Puede tomar valores 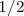 o
o 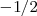 .
.
Dos electrones no pueden tener los cuatro numeros cuanticos iguales, por eso cada orbital puede alojar un maximo de dos electrones (uno con spin +1/2 y otro con spin -1/2).
| Numero cuantico | Nombre | Significado | Posibles valores |
|---|---|---|---|
| n | Principal | Nivel de energia | 1,2,3,4... |
| l | Momento Angular | Momento angular del orbital (forma) | 0 (s), 1 (p), 2 (d), 3 (f),.. n-1 |
| m | Magnetico | Momento magnetico del orbital (orientacion) | -l, -l+1,..0, ...l-1, +l |
| s | Spin | Spin electronico | +1/2 o -1/2 |



