Concepto de transferencia de electrones. Par forma oxidada y forma reducida. Diferencia entre valencia y estado de oxidación. Número de oxidación
De Wikillerato
(→NÚMERO DE OXIDACIÓN) |
|||
| (Una edición intermedia no se muestra.) | |||
| Línea 1: | Línea 1: | ||
| - | == | + | == Reacciones de Oxidación-Reducción (Redox)== |
| + | Una reacción de oxidación-reducción (abreviadamente reacciones redox) es un proceso en el cual los [[electrones]] son transferidos de una sustancia a otra. | ||
| + | Históricamente la palabra oxidación se refería a la combinación de un elemento con el oxígeno para producir un óxido, y el término reducción a la eliminación del oxígeno para producir el elemento. | ||
| - | [[Categoría:Química]] | + | Los procesos redox han sido cruciales para el desarrollo de la civilización humana y tiene un enorme valor comercial. La oxidación del hierro por reacción con el aire para formar herrumbre fue conocida durante milenios y todavía es un serio problema que causa enormes daños en las construcciones, puentes y automóviles. Por otra parte la reducción del óxido de hierro <math> Fe_2O_3 </math> con carbón (C) para elaborar metal de hierro fue realizado desde los tiempos prehistóricos y todavía es utilizado en la elaboración del acero. |
| + | |||
| + | <math>4 Fe (s) + 3 O_2(g) --> 2Fe_2O_3(s) </math> Oxidación del hierro (Fe) | ||
| + | <math> 2 Fe_2O_3 (s) + 3 C (s) --> 4Fe (s) + 3O_2 (g) </math> Reducción del hierro (Fe) | ||
| + | |||
| + | Hoy los conceptos de oxidación y reducción tiene un significado más amplio: | ||
| + | |||
| + | Una sustancia sufre una oxidación cuando pierde electrones. Esto es la oxidación es la pérdida de uno o más electrones por una sustancia | ||
| + | |||
| + | Una sustancia sufre reducción cuando gana electrones. Esto es una reducción es la ganancia de uno o más electrones por una sustancia. | ||
| + | |||
| + | En toda reacción redox: | ||
| + | |||
| + | - El oxidante gana electrones, mientras que el reductor los pierde. | ||
| + | |||
| + | - Durante la reacción, el reductor se oxida y el oxidante se reduce | ||
| + | |||
| + | De esta manera todo proceso de oxidación está vinculado necesariamente a otro proceso complementario de reducción: en un sistema químico para que una sustancia ceda electrones, otra tiene que captarlos, constituyendo con ello un ''par redox''. Es decir en una reacción de oxidación-reducción siempre interviene un par redox. | ||
| + | |||
| + | |||
| + | ==Número de Oxidación== | ||
| + | |||
| + | El '''número de oxidación''' (abreviadamente ''nox''), también llamado a veces ''estado de oxidación'', es simplemente un intento convencional de describir el estado electrónico de la capa de valencia de un átomo en un compuesto. Así, los números de oxidación son simplemente una mecanismo conveniente que ayuda a seguir el "rastro" de los electrones en las reacciones redox. | ||
| + | |||
| + | Si el compuesto es iónico, el número de oxidación se identifica con la carga iónica de cada elemento. Por ejemplo en <math> NaCl </math> el nox del sodio es <math> + 1 </math>, y el del cloro <math> -1 </math>. | ||
| + | |||
| + | Si el compuesto es covalente, los electrones de los [[enlaces covalente polares]] son asignados al elemento más [[electronegativo]], convirtiendo el enlace covalentemente polar en enlace hipotéticamente iónico. Así en el ácido clorhídrico <math> HCl </math>, el par de electrones compartidos se le asigna al cloro, que es más electronegativo que el hidrógeno, con lo que el nox del cloro será <math> -1 </math> y el del hidrógeno <math> + 1 </math>. | ||
| + | |||
| + | Las reglas para asignar números de oxidación son las siguientes: | ||
| + | |||
| + | '''1.-''' Un átomo en su estado elemental tienen un número de oxidación de <math> 0 </math> | ||
| + | |||
| + | '''2.-''' Un átomo en un ión monoatómico el nox es idéntico a su carga iónica. | ||
| + | |||
| + | '''3.-''' Un átomo en un ión poliatómico o en una molécula compuesta generalmente tiene el mismo número de oxidación que podría tener que si estuviera en un ión monoatómico. | ||
| + | |||
| + | Por ejemplo en el ión hidróxido <math> OH^- </math> el átomo de oxígeno tiene un nox de <math> -2 </math>, como si fuera un ión monoatómico <math> O^{2-} </math> , y el átomo de hidrógeno tiene un número de oxidación de <math> + 1 </math>, como si fuera el ión <math> H^+</math>. | ||
| + | |||
| + | a.- El hidrógeno puede tener un nox de <math> -1 </math> o <math> + 1 </math>. Cuando se combina con los no metales (e.g. C, N, O o Cl) , el hidrógeno tiene siempre un nox de <math> -1 </math>. En cambio cunado está unido a un metal (e.g. Na, Ca) el hidrógeno tiene un número de oxidación de <math> + 1 </math>. | ||
| + | |||
| + | b.- El oxígeno tiene generalmente un nox de <math> 2^+ </math>, salvo en los [[peróxidos]], que tiene un nox de <math> -1 </math>, y en su combinaciones con el fluor que al ser más electronegativo le fuerza a tener al oxígeno un nox de <math> -2</math> | ||
| + | |||
| + | c. Los [[metales alcalinos]] ((grupo 1 de la tabla periodica: Li, Na, K, Rb, Cs y Fr)) tienen un nox de <math> -1 </math>, y de los [[alcalinos térreos]] ((grupo 2 de la tabla periodica: Be, Mg, Ca, Sr, Ba y Ra)) siempre es de <math> 2+ </math>. | ||
| + | |||
| + | d. Los [[halógenos]], en los [[haluros]], tienen en general un número de oxidación de <math> -1 </math>. La principal excepción se produce en compuestos donde el átomo de halógeno está unido al oxígeno. En tales casos el átomo de oxígeno tiene un nox de <math> -2 </math> y el halógeno tiene un número positivo de nox. Por ejemplo en compuesto <math> Cl_2O </math> el átomo de oxígeno tienen un número de oxidación de <math> -2 </math> y cada átomo de cloro tiene un número de oxidación de <math> -1 </math> | ||
| + | |||
| + | '''4.-''' La suma algebraica de los número de oxidación es cero (<math> 0 </math> para un compuesto neutro y es igual a la carga neta para un ión poliatómico. Esta regla es particularmente útil para hallar el número de oxidación en casos difíciles. La idea general es asignar el número de oxidación a los átomos “fáciles” primero y entonces encontrar el número de oxidación al átomo que presenta más dificultad por substracción. | ||
| + | |||
| + | Por ejemplo aplicando las reglas anteriores para el ácido sulfúrico <math> H_2SO_4 </math>. El nox para el hidrógeno será de <math> + 1 </math>, y para el O será de <math> 2- </math>. Hay que deducir el nox del azufre (<math> S</math>) al que llamaremos “x”. Aplicando la regla 4 de neutralidad global para el ácido sulfúrico se puede plantear la siguiente ecuación: | ||
| + | |||
| + | <math> 2 (+1) + x + 4 (-2) = 0 </math> | ||
| + | |||
| + | Resolviendo la ecuación encontramos que <math>x=+6</math> | ||
| + | De esta manera el número de oxidación del S en el ácido sulfúrico es de <math> + 6 </math>. | ||
| + | |||
| + | Para el número de oxidación del átomo de cloro en el anión perclorato (<math>ClO_4^- </math>), un ión poliatómico, teniendo en cuenta la regla 3b que el nox del oxígeno es al estar unido a un halógeno (Cl) es de <math> -2</math>, el átomo de cloro debe tener un número de oxidación de <math> +7 </math> para que la carga neta del anión perclorato sea de <math> -1 </math> . Esto es en la ecuación: | ||
| + | |||
| + | <math> x + 4 (-2) =- 1 </math> o <math> x-8=-1 </math>, | ||
| + | |||
| + | Donde <math> x </math> es la incógnita y es igual al número de oxidación del cloro | ||
| + | Resolviendo la ecuación tenemos que <math>x=+7 </math> | ||
| + | |||
| + | Para encontrar el número de oxidación del átomo del átomo de nitrógeno en el catión amonio (<math>NH_4^+ </math>, si cada átomo de <math>H </math> tiene un número de oxidación de <math> + 1 </math>, así que el átomo de N debe tener un número de oxidación de <math>-3</math> para que la carga neta del ión amonio sea de <math> + 1 </math>. | ||
| + | |||
| + | Teniendo en cuenta el concepto de número de oxidación, en una reacción redox un elemento sufre oxidación cuando aumenta su número de oxidación y reducción cuando disminuye. Una oxidación pues es una perdida de electrones (un incremento en el número de oxidación) y una reducción es una ganacia de electrones (una disminución en el número de oxidación). | ||
| + | |||
| + | Hay que señalar aquí que “aumento” significa crecimiento relativo de número. Así, si el nox de un elemento pasa de <math> -3 </math> a <math> -2 </math>, está aumentando su valor relativo y por lo tanto se está oxidando. | ||
| + | |||
| + | De esta manera se puede distinguir fácilmente las reacciones redox de las que no lo son. En cuanto se produzca algún cambio del nox en algún elemento al pasar del primer miembro de la reacción (parte izquierda) al segundo (parte derecha), podemos asegurar que se trata de una reacción de oxidación reducción. Teniendo en cuenta siempre que en todo proceso de oxidación de un elemento va acompañado necesariamente de la reducción de otro elemento. | ||
| + | |||
| + | [[Categoría: Química]] | ||
Revisión actual
Reacciones de Oxidación-Reducción (Redox)
Una reacción de oxidación-reducción (abreviadamente reacciones redox) es un proceso en el cual los electrones son transferidos de una sustancia a otra.
Históricamente la palabra oxidación se refería a la combinación de un elemento con el oxígeno para producir un óxido, y el término reducción a la eliminación del oxígeno para producir el elemento.
Los procesos redox han sido cruciales para el desarrollo de la civilización humana y tiene un enorme valor comercial. La oxidación del hierro por reacción con el aire para formar herrumbre fue conocida durante milenios y todavía es un serio problema que causa enormes daños en las construcciones, puentes y automóviles. Por otra parte la reducción del óxido de hierro 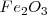 con carbón (C) para elaborar metal de hierro fue realizado desde los tiempos prehistóricos y todavía es utilizado en la elaboración del acero.
con carbón (C) para elaborar metal de hierro fue realizado desde los tiempos prehistóricos y todavía es utilizado en la elaboración del acero.
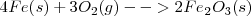 Oxidación del hierro (Fe)
Oxidación del hierro (Fe)
 Reducción del hierro (Fe)
Reducción del hierro (Fe)
Hoy los conceptos de oxidación y reducción tiene un significado más amplio:
Una sustancia sufre una oxidación cuando pierde electrones. Esto es la oxidación es la pérdida de uno o más electrones por una sustancia
Una sustancia sufre reducción cuando gana electrones. Esto es una reducción es la ganancia de uno o más electrones por una sustancia.
En toda reacción redox:
- El oxidante gana electrones, mientras que el reductor los pierde.
- Durante la reacción, el reductor se oxida y el oxidante se reduce
De esta manera todo proceso de oxidación está vinculado necesariamente a otro proceso complementario de reducción: en un sistema químico para que una sustancia ceda electrones, otra tiene que captarlos, constituyendo con ello un par redox. Es decir en una reacción de oxidación-reducción siempre interviene un par redox.
Número de Oxidación
El número de oxidación (abreviadamente nox), también llamado a veces estado de oxidación, es simplemente un intento convencional de describir el estado electrónico de la capa de valencia de un átomo en un compuesto. Así, los números de oxidación son simplemente una mecanismo conveniente que ayuda a seguir el "rastro" de los electrones en las reacciones redox.
Si el compuesto es iónico, el número de oxidación se identifica con la carga iónica de cada elemento. Por ejemplo en 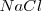 el nox del sodio es
el nox del sodio es 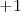 , y el del cloro
, y el del cloro 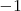 .
.
Si el compuesto es covalente, los electrones de los enlaces covalente polares son asignados al elemento más electronegativo, convirtiendo el enlace covalentemente polar en enlace hipotéticamente iónico. Así en el ácido clorhídrico 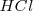 , el par de electrones compartidos se le asigna al cloro, que es más electronegativo que el hidrógeno, con lo que el nox del cloro será
, el par de electrones compartidos se le asigna al cloro, que es más electronegativo que el hidrógeno, con lo que el nox del cloro será 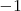 y el del hidrógeno
y el del hidrógeno 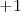 .
.
Las reglas para asignar números de oxidación son las siguientes:
1.- Un átomo en su estado elemental tienen un número de oxidación de 
2.- Un átomo en un ión monoatómico el nox es idéntico a su carga iónica.
3.- Un átomo en un ión poliatómico o en una molécula compuesta generalmente tiene el mismo número de oxidación que podría tener que si estuviera en un ión monoatómico.
Por ejemplo en el ión hidróxido 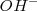 el átomo de oxígeno tiene un nox de
el átomo de oxígeno tiene un nox de 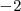 , como si fuera un ión monoatómico
, como si fuera un ión monoatómico 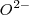 , y el átomo de hidrógeno tiene un número de oxidación de
, y el átomo de hidrógeno tiene un número de oxidación de 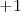 , como si fuera el ión
, como si fuera el ión 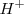 .
.
a.- El hidrógeno puede tener un nox de 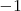 o
o 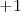 . Cuando se combina con los no metales (e.g. C, N, O o Cl) , el hidrógeno tiene siempre un nox de
. Cuando se combina con los no metales (e.g. C, N, O o Cl) , el hidrógeno tiene siempre un nox de 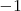 . En cambio cunado está unido a un metal (e.g. Na, Ca) el hidrógeno tiene un número de oxidación de
. En cambio cunado está unido a un metal (e.g. Na, Ca) el hidrógeno tiene un número de oxidación de 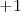 .
.
b.- El oxígeno tiene generalmente un nox de 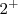 , salvo en los peróxidos, que tiene un nox de
, salvo en los peróxidos, que tiene un nox de 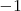 , y en su combinaciones con el fluor que al ser más electronegativo le fuerza a tener al oxígeno un nox de
, y en su combinaciones con el fluor que al ser más electronegativo le fuerza a tener al oxígeno un nox de 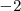
c. Los metales alcalinos ((grupo 1 de la tabla periodica: Li, Na, K, Rb, Cs y Fr)) tienen un nox de 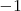 , y de los alcalinos térreos ((grupo 2 de la tabla periodica: Be, Mg, Ca, Sr, Ba y Ra)) siempre es de
, y de los alcalinos térreos ((grupo 2 de la tabla periodica: Be, Mg, Ca, Sr, Ba y Ra)) siempre es de 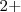 .
.
d. Los halógenos, en los haluros, tienen en general un número de oxidación de 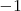 . La principal excepción se produce en compuestos donde el átomo de halógeno está unido al oxígeno. En tales casos el átomo de oxígeno tiene un nox de
. La principal excepción se produce en compuestos donde el átomo de halógeno está unido al oxígeno. En tales casos el átomo de oxígeno tiene un nox de 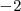 y el halógeno tiene un número positivo de nox. Por ejemplo en compuesto
y el halógeno tiene un número positivo de nox. Por ejemplo en compuesto 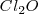 el átomo de oxígeno tienen un número de oxidación de
el átomo de oxígeno tienen un número de oxidación de 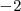 y cada átomo de cloro tiene un número de oxidación de
y cada átomo de cloro tiene un número de oxidación de 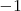
4.- La suma algebraica de los número de oxidación es cero ( para un compuesto neutro y es igual a la carga neta para un ión poliatómico. Esta regla es particularmente útil para hallar el número de oxidación en casos difíciles. La idea general es asignar el número de oxidación a los átomos “fáciles” primero y entonces encontrar el número de oxidación al átomo que presenta más dificultad por substracción.
para un compuesto neutro y es igual a la carga neta para un ión poliatómico. Esta regla es particularmente útil para hallar el número de oxidación en casos difíciles. La idea general es asignar el número de oxidación a los átomos “fáciles” primero y entonces encontrar el número de oxidación al átomo que presenta más dificultad por substracción.
Por ejemplo aplicando las reglas anteriores para el ácido sulfúrico 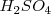 . El nox para el hidrógeno será de
. El nox para el hidrógeno será de 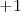 , y para el O será de
, y para el O será de 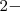 . Hay que deducir el nox del azufre (
. Hay que deducir el nox del azufre (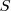 ) al que llamaremos “x”. Aplicando la regla 4 de neutralidad global para el ácido sulfúrico se puede plantear la siguiente ecuación:
) al que llamaremos “x”. Aplicando la regla 4 de neutralidad global para el ácido sulfúrico se puede plantear la siguiente ecuación:
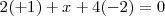
Resolviendo la ecuación encontramos que 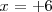 De esta manera el número de oxidación del S en el ácido sulfúrico es de
De esta manera el número de oxidación del S en el ácido sulfúrico es de 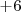 .
.
Para el número de oxidación del átomo de cloro en el anión perclorato (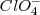 ), un ión poliatómico, teniendo en cuenta la regla 3b que el nox del oxígeno es al estar unido a un halógeno (Cl) es de
), un ión poliatómico, teniendo en cuenta la regla 3b que el nox del oxígeno es al estar unido a un halógeno (Cl) es de 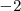 , el átomo de cloro debe tener un número de oxidación de
, el átomo de cloro debe tener un número de oxidación de 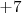 para que la carga neta del anión perclorato sea de
para que la carga neta del anión perclorato sea de 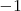 . Esto es en la ecuación:
. Esto es en la ecuación:
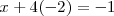 o
o 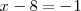 ,
,
Donde  es la incógnita y es igual al número de oxidación del cloro
Resolviendo la ecuación tenemos que
es la incógnita y es igual al número de oxidación del cloro
Resolviendo la ecuación tenemos que 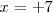
Para encontrar el número de oxidación del átomo del átomo de nitrógeno en el catión amonio (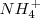 , si cada átomo de
, si cada átomo de 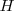 tiene un número de oxidación de
tiene un número de oxidación de 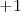 , así que el átomo de N debe tener un número de oxidación de
, así que el átomo de N debe tener un número de oxidación de 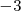 para que la carga neta del ión amonio sea de
para que la carga neta del ión amonio sea de 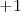 .
.
Teniendo en cuenta el concepto de número de oxidación, en una reacción redox un elemento sufre oxidación cuando aumenta su número de oxidación y reducción cuando disminuye. Una oxidación pues es una perdida de electrones (un incremento en el número de oxidación) y una reducción es una ganacia de electrones (una disminución en el número de oxidación).
Hay que señalar aquí que “aumento” significa crecimiento relativo de número. Así, si el nox de un elemento pasa de 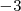 a
a 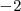 , está aumentando su valor relativo y por lo tanto se está oxidando.
, está aumentando su valor relativo y por lo tanto se está oxidando.
De esta manera se puede distinguir fácilmente las reacciones redox de las que no lo son. En cuanto se produzca algún cambio del nox en algún elemento al pasar del primer miembro de la reacción (parte izquierda) al segundo (parte derecha), podemos asegurar que se trata de una reacción de oxidación reducción. Teniendo en cuenta siempre que en todo proceso de oxidación de un elemento va acompañado necesariamente de la reducción de otro elemento.
Tweet


