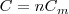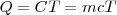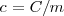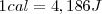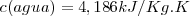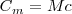Calor y Trabajo en procesos termodinámicos
De Wikillerato
Calor
El calor es definido como la transferencia de energía a través de una frontera de un sistema debido a la diferencia de temperatura entre el sistema y su entorno. Como resultado de los experimentos de Joule y de muchos otros hechos después realizados por otros científicos, se ha comprendido que el calor no es una substancia, sino más bien una forma de transferencia de energía. Así cuando el calor fluye de un objeto caliente a otro más frío, es la energía la que está siendo transferida del primero al segundo. Esto es, el calor es la energía intercambiada (transferida) entre dos sistemas (e.g de un cuerpo a otro) debido a su diferencia de temperatura, es por tanto, una energía en tránsito desde el sistema (foco) más caliente al más frío. El calor es energía en transito, por ello es incorrecto decir el “calor de un cuerpo” al igual que decir “el trabajo de un cuerpo”. Durante el calentamiento de un sistema, la energía fluye de una parte del sistema a otra o de un sistema a otro en virtud de su diferencia de temperaturas. Por lo tanto, es incorrecto hablar de calor que posee un sistema. Esto es, el calor Q no es una función de las coordenadas esto es no es una función de estado.
El “calor” al igual que el “trabajo” son modos de transferencia de energía, no formas de energía y no son funciones de estado del sistema. La energía puede ser intercambiada entre un sistema cerrado y sus alrededores haciendo trabajo o por transferencia de calor. El calentamiento (heating en inglés) es el proceso de transferencia de energía como resultado de una diferencia de temperatura entre el sistema y sus alrededores. Un sistema hace trabajo cuando causa movimiento frente a una fuerza opositora. El calor y el trabajo son variables energéticas de transito convertibles entre si. Una máquina de vapor es un ejemplo de una máquina diseñada para convertir calor en trabajo. Por otra parte el giro de una rueda con paletas en un tanque de agua produce calor por fricción representa el proceso inverso, la conversión de trabajo en calor (e.g. experimento de Joule).
Cuando se transfiere calor a un cuerpo, y no hay cambio en la energía cinética o potencial del sistema, la temperatura normalmente del mismo aumenta (una excepción a este lo constituyen los cambios de fase o transición de fase que puede sufrir el sistema, como al congelar o vaporizar el agua). La cantidad de energía térmica (denotada por Q) necesaria (i.e. que debe ser transferida por calentamiento) para elevar la temperatura de un sistema es proporcional a la variación de temperatura (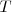 ) y a la masa (
) y a la masa (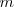 ) de la sustancia:
) de la sustancia:
Donde 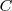 es la capacidad térmica o calorífica de la sustancia, que se define como la energía térmica que se necesita para aumentar un grado la temperatura de la sustancia. El calor específico c es la capacidad térmica por unidad de masa (
es la capacidad térmica o calorífica de la sustancia, que se define como la energía térmica que se necesita para aumentar un grado la temperatura de la sustancia. El calor específico c es la capacidad térmica por unidad de masa (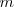 ):
):
La capacidad térmica es esencialmente una medida de cómo de insensibilidad térmica muestra una sustancia a la adición de energía térmica. Cuanto más grande es la capacidad térmica, más energía debe ser añadida a una determinada masa de material para causar un cambio particular de temperatura.
Históricamente se definió la unidad térmica de calor o caloría, como la cantidad de energía térmica necesaria para elevar la temperatura de un gramo de agua en un grado Celsius (ºC) (o un kelvin (K), puesto que el grado Celsius y el kelvin tienen el mismo tamaño). La kilocaloria es, entonces, la cantidad de energía térmica necesaria para aumentar la temperatura de un kilogramo de agua en un grado Celsius.
Dado que hoy sabemos que el calor es una forma de transferencia de energía, no necesitamos ninguna unidad especial para el calor que sea diferente de otras unidades de energía. Se define en la actualidad la caloría en función de la unidad del SI de la energía el julio (J)
Según la definición original de caloría, el calor específico del agua es
Medidas cuidadosas demuestran que el calor específico del agua varia ligeramente con la temperatura, pero esta variación es sólo del orden del 1% en todo el margen de la temperatura de 0ºC a 100ºC. el valor 4,186 J se refiere al intervalo de temperatura 14.5-15.5 ºC.
Por otra parte la cantidad de energía térmica requerida para aumentar la temperatura de 1 kg de cobre en 1 ºC es solo de 387 J (unas diez veces superior. Debido a la alta capacidad calorífica del agua, es un material excelente para almacenar energía térmica, como en un sistema de energía solar. También es un excelente refrigerante. Una gra masa de agua, como un lago o un mar tienden a moderar las variaciones de temperatura en sus cercanías porque pueden absorber o desprender grandes cantidades de energía térmica experimentando solo cambios pequeños de temperatura.
La capacidad calorífica por mol se denomina capacidad térmica molar 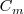 . La capacidad térmica molar es igual al calor específico (capacidad calorífica por unidad de masa) multiplicando por la masa molar M (masa por mol)
. La capacidad térmica molar es igual al calor específico (capacidad calorífica por unidad de masa) multiplicando por la masa molar M (masa por mol)
Resultando que la capacidad calorífica de n moles de una sustancia es:
Tweet