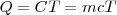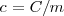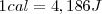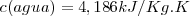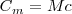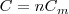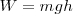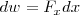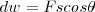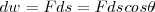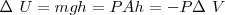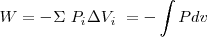Calor y Trabajo en procesos termodinámicos
De Wikillerato
(→Calor) |
|||
| Línea 7: | Línea 7: | ||
Cuando se transfiere calor a un cuerpo, y no hay cambio en la energía cinética o potencial del sistema, la temperatura normalmente del mismo aumenta (una excepción a este lo constituyen los cambios de fase o transición de fase que puede sufrir el sistema, como al congelar o vaporizar el agua). La cantidad de energía térmica (denotada por Q) necesaria (i.e. que debe ser transferida por calentamiento) para elevar la temperatura de un sistema es proporcional a la variación de temperatura (<math>ΔT </math>) y a la masa (<math>m</math>) de la sustancia: | Cuando se transfiere calor a un cuerpo, y no hay cambio en la energía cinética o potencial del sistema, la temperatura normalmente del mismo aumenta (una excepción a este lo constituyen los cambios de fase o transición de fase que puede sufrir el sistema, como al congelar o vaporizar el agua). La cantidad de energía térmica (denotada por Q) necesaria (i.e. que debe ser transferida por calentamiento) para elevar la temperatura de un sistema es proporcional a la variación de temperatura (<math>ΔT </math>) y a la masa (<math>m</math>) de la sustancia: | ||
| - | <math>Q = CΔT=mcT </math> | + | <math>Q = CΔT=mcT </math> |
| Línea 36: | Línea 36: | ||
Resultando que la capacidad calorífica de <math>n</math> moles de una sustancia es: | Resultando que la capacidad calorífica de <math>n</math> moles de una sustancia es: | ||
| - | <math>C=nC_m</math> | + | <math>C=nC_m</math> |
| + | |||
==Trabajo== | ==Trabajo== | ||
Revisión de 10:08 8 feb 2012
Calor
El calor es definido como la transferencia de energía a través de una frontera de un sistema debido a la diferencia de temperatura entre el sistema y su entorno. Como resultado de los experimentos de Joule y de muchos otros hechos después realizados por otros científicos, se ha comprendido que el calor no es una substancia, sino más bien una forma de transferencia de energía. Así cuando el calor fluye de un objeto caliente a otro más frío, es la energía la que está siendo transferida del primero al segundo. Esto es, el calor es la energía intercambiada (transferida) entre dos sistemas (e.g de un cuerpo a otro) debido a su diferencia de temperatura, es por tanto, una energía en tránsito desde el sistema (foco) más caliente al más frío. El calor es energía en transito, por ello es incorrecto decir el “calor de un cuerpo” al igual que decir “el trabajo de un cuerpo”. Durante el calentamiento de un sistema, la energía fluye de una parte del sistema a otra o de un sistema a otro en virtud de su diferencia de temperaturas. Por lo tanto, es incorrecto hablar de calor que posee un sistema. Esto es, el calor Q no es una función de las coordenadas esto es no es una función de estado.
El “calor” al igual que el “trabajo” son modos de transferencia de energía, no formas de energía y no son funciones de estado del sistema. La energía puede ser intercambiada entre un sistema cerrado y sus alrededores haciendo trabajo o por transferencia de calor. El calentamiento (heating en inglés) es el proceso de transferencia de energía como resultado de una diferencia de temperatura entre el sistema y sus alrededores. Un sistema hace trabajo cuando causa movimiento frente a una fuerza opositora. El calor y el trabajo son variables energéticas de transito convertibles entre si. Una máquina de vapor es un ejemplo de una máquina diseñada para convertir calor en trabajo. Por otra parte el giro de una rueda con paletas en un tanque de agua produce calor por fricción representa el proceso inverso, la conversión de trabajo en calor (e.g. experimento de Joule).
Cuando se transfiere calor a un cuerpo, y no hay cambio en la energía cinética o potencial del sistema, la temperatura normalmente del mismo aumenta (una excepción a este lo constituyen los cambios de fase o transición de fase que puede sufrir el sistema, como al congelar o vaporizar el agua). La cantidad de energía térmica (denotada por Q) necesaria (i.e. que debe ser transferida por calentamiento) para elevar la temperatura de un sistema es proporcional a la variación de temperatura (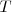 ) y a la masa (
) y a la masa (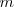 ) de la sustancia:
) de la sustancia:
Donde 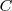 es la capacidad térmica o calorífica de la sustancia, que se define como la energía térmica que se necesita para aumentar un grado la temperatura de la sustancia. El calor específico
es la capacidad térmica o calorífica de la sustancia, que se define como la energía térmica que se necesita para aumentar un grado la temperatura de la sustancia. El calor específico  es la capacidad térmica por unidad de masa (
es la capacidad térmica por unidad de masa (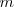 ):
):
La capacidad térmica es esencialmente una medida de cómo de insensibilidad térmica muestra una sustancia a la adición de energía térmica. Cuanto más grande es la capacidad térmica, más energía debe ser añadida a una determinada masa de material para causar un cambio particular de temperatura.
Históricamente se definió la unidad térmica de calor o caloría, como la cantidad de energía térmica necesaria para elevar la temperatura de un gramo de agua en un grado Celsius (ºC) (o un kelvin (K), puesto que el grado Celsius y el kelvin tienen el mismo tamaño). La kilocaloria es, entonces, la cantidad de energía térmica necesaria para aumentar la temperatura de un kilogramo de agua en un grado Celsius.
Dado que hoy sabemos que el calor es una forma de transferencia de energía, no necesitamos ninguna unidad especial para el calor que sea diferente de otras unidades de energía. Se define en la actualidad la caloría en función de la unidad del SI de la energía el julio (J)
Según la definición original de caloría, el calor específico del agua es:
Medidas cuidadosas demuestran que el calor específico del agua varia ligeramente con la temperatura, pero esta variación es sólo del orden del 1% en todo el margen de la temperatura de 0ºC a 100ºC. el valor 4,186 J se refiere al intervalo de temperatura 14.5-15.5 ºC.
Por otra parte la cantidad de energía térmica requerida para aumentar la temperatura de 1 kg de cobre en 1 ºC es solo de 387 J (unas diez veces superior. Debido a la alta capacidad calorífica del agua, es un material excelente para almacenar energía térmica, como en un sistema de energía solar. También es un excelente refrigerante. Una gra masa de agua, como un lago o un mar tienden a moderar las variaciones de temperatura en sus cercanías porque pueden absorber o desprender grandes cantidades de energía térmica experimentando solo cambios pequeños de temperatura.
La capacidad calorífica por mol se denomina capacidad térmica molar 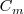 . La capacidad térmica molar es igual al calor específico (capacidad calorífica por unidad de masa) multiplicando por la masa molar M (masa por mol)
. La capacidad térmica molar es igual al calor específico (capacidad calorífica por unidad de masa) multiplicando por la masa molar M (masa por mol)
Resultando que la capacidad calorífica de  moles de una sustancia es:
moles de una sustancia es:
Trabajo
La medida cuantitativa del trabajo fue introducida por Nicolas Leonard Carnot (1796-1832), quien definió la cantidad de trabajo hecho sobre un objeto como el producto de la altura 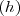 a la que es elevado por peso de este
a la que es elevado por peso de este 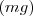 . Esta definición fue extendida por Gaspard de Coriolis (1792-1843) quien proporcionó la actual definición de trabajo
. Esta definición fue extendida por Gaspard de Coriolis (1792-1843) quien proporcionó la actual definición de trabajo 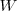 :
:
La cantidad de trabajo hecho sobre un objeto es igual a la fuerza ejercida en él por la distancia en la es que movido en la dirección de la fuerza i.e. el producto de la fuerza por el desplazamiento del punto sobre el cual actúa la fuerza.
El trabajo se realiza sobre una fuerza sobre un cuerpo sólo cuando el punto de aplicación de la fuerza se mueve a través de una distancia y existe un componente de la fuerza a lo largo de la línea de movimiento. Así cuando se ejerce una fuerza sobre un trineo y éste se mueve a través de la nieve, se realiza un trabajo sobre el trineo. Sin embargo, si el trineo se inmovilizara (por ejemplo atándolo a un árbol) y se ejerciera sobre él la misma fuerza que en le caso anterior, no se verificaría ningún trabajo sobre el trineo porque el punto de aplicación de la fuerza no se mueva a través de la distancia.
Si la fuerza es 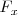 ejercida sobre un objeto en la dirección
ejercida sobre un objeto en la dirección  , el trabajo hecho en el objeto en un desplazamiento infinitesimal
, el trabajo hecho en el objeto en un desplazamiento infinitesimal 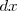 en la dirección
en la dirección  es:
es:
Donde 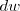 es la cantidad de trabajo.
es la cantidad de trabajo.
Si la fuerza y el desplazamiento poseen direcciones diferentes, entonces sólo trabaja la componente de la fuerza en la dirección al desplazamiento. Esto es Fuerza y desplazamiento deben ser tratados como vectores. La fuerza 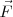 y el desplazamiento
y el desplazamiento 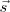 son pues cantidades vectoriales. El producto escalar de dos vectores es un cantidad escalar. El resultado de esta operación es:
son pues cantidades vectoriales. El producto escalar de dos vectores es un cantidad escalar. El resultado de esta operación es:
Donde 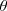 , es el ángulo entre los vectores
, es el ángulo entre los vectores 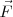 y el vector
y el vector 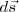 .
.
La cantidad de trabajo 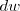 puede ser escrito como el producto escalar de dos vectors
puede ser escrito como el producto escalar de dos vectors 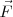 y
y 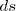 donde
donde 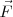 es la fuerza ejercida sobre el objeto y
es la fuerza ejercida sobre el objeto y 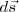 es el desplazamiento:
es el desplazamiento:
donde 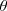 es el ángulo entre los vectores
es el ángulo entre los vectores 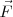 y
y 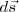
El producto escalar es denotado por 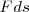
Es definido por la segunda igualdad en la ecuación, la cual contiene la magnitud de los vectores. El producto 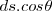 es la magnitud escalar del componente del vector desplazamiento en la dirección de la fuerza. Solo el componente del desplazamiento en la dirección de la fuerza es efectivo en determinar la cantidad de trabajo. No se realiza trabajo si el objeto no se muevo o la fuerza y el desplazamiento son perpendiculares entre si, entonces el ángulo
es la magnitud escalar del componente del vector desplazamiento en la dirección de la fuerza. Solo el componente del desplazamiento en la dirección de la fuerza es efectivo en determinar la cantidad de trabajo. No se realiza trabajo si el objeto no se muevo o la fuerza y el desplazamiento son perpendiculares entre si, entonces el ángulo 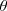 entre los vectores es
entre los vectores es 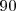 y el
y el 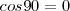 .
.
Para un proceso finito se puede dividir el proceso en pequeñas etapas de tal manera que la fuerza sea constante en cada etapa, entonces el trabajo hecho sobre el objeto en el proceso entero es obtenido sumando el trabajo hecho en todas las etapas. En el límite en el que el tamaño de la etapa se aproxima a cero la suma se convierte en una integral. Si el desplazamiento y la fuerza están ambas en la dirección  esta integral es:
esta integral es:
Donde 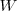 denota la cantidad de trabajo hecho en un proceso finito.
denota la cantidad de trabajo hecho en un proceso finito.
El trabajo es una magnitud escalar que es positiva si 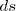 y
y 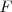 tiene signos iguales y negativa si tienen opuestos.
tiene signos iguales y negativa si tienen opuestos.
Las dimensiones del trabajo son la de una fuerza por una distancia.La Unidad del SI de fuerza es el Newton (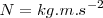 ) y la SI unidad del trabajo es el Julio (
) y la SI unidad del trabajo es el Julio (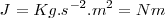 )
)
Cuando un sistema realiza trabajo sobre otro, se transfiere energía entre los dos sistemas
Trabajo y calor son dos formas de transferencia de energía, no formas de energía.
Trabajo termodinámico: de expansión (o de comprensión)
La transferencia de energía interna asociada a una variación de volumen se denomina trabajo termodinámico. Una forma de trabajo muy importante es la relacionada con los cambios de volumen, expansiones o comprensiones, que tiene lugar en un sistema bajo la acción de una presión exterior.
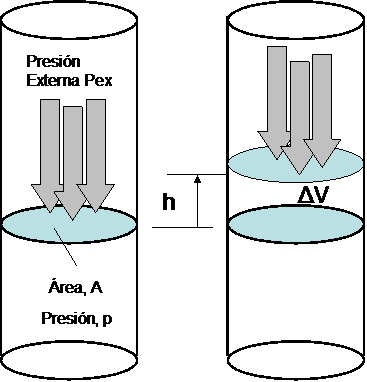
Consideremos un sistema termodinámico simple (i.e. un sistema que solo puede intercambiar trabajo con sus alrededores solo por cambio de volumen el cual es denominado trabajo P-V), compuesto por un gas contenido en un recipiente cerrado (e.g. un cilindro) por arriba mediante un tabique móvil (pistón) sin rozamiento que inicialmente ocupa un volumen 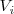 . Tanto el tabique móvil como las paredes fijas son paredes adiabáticas impermeables, de modo que el gas solo puede ganar energía interna si incrementa de volumen. Sobre el pistón se aplica una fuerza externa que ejerce una presión exterior (
. Tanto el tabique móvil como las paredes fijas son paredes adiabáticas impermeables, de modo que el gas solo puede ganar energía interna si incrementa de volumen. Sobre el pistón se aplica una fuerza externa que ejerce una presión exterior (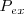 ). Si la fuerza externa ejercida sobre el pistón es más grande que la fuerza ejercida en el pistón por el sistema, el pistón se acelerará hacia abajo (disminuyendo el volumen del sistema). Por el contrario si la fuerza del exterior es más pequeña acelerará hacia arriba y el sistema realizará trabajo sobre el ambiente.
). Si la fuerza externa ejercida sobre el pistón es más grande que la fuerza ejercida en el pistón por el sistema, el pistón se acelerará hacia abajo (disminuyendo el volumen del sistema). Por el contrario si la fuerza del exterior es más pequeña acelerará hacia arriba y el sistema realizará trabajo sobre el ambiente.
Por ejemplo, si sobre la superficie móvil de área 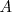 colocamos un peso
colocamos un peso 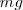 , la posición de equilibrio será aquella para la que la presión ejercida por el gas sobre el tabique compense la presión ejercida por el peso, es decir
, la posición de equilibrio será aquella para la que la presión ejercida por el gas sobre el tabique compense la presión ejercida por el peso, es decir 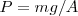 . Si ahora quitamos un incremento de peso infinitesimal sobre el tabique, la presión interna superara en una pequeña cantidad la
. Si ahora quitamos un incremento de peso infinitesimal sobre el tabique, la presión interna superara en una pequeña cantidad la 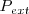 y el tabique se desplazará hacia arriba una pequeña distancia
y el tabique se desplazará hacia arriba una pequeña distancia 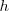 para reestablecer el equilibrio de presiones el gas se habrá expansionado hasta un volumen
para reestablecer el equilibrio de presiones el gas se habrá expansionado hasta un volumen 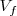 , desplazando el pistón una distancia
, desplazando el pistón una distancia 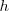 hacia arriba venciendo la presión exterior
hacia arriba venciendo la presión exterior 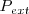 que es constante. En este proceso el peso habrá ganado una energía potencial
que es constante. En este proceso el peso habrá ganado una energía potencial 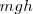 y esta misma energía habrá sido perdida por el gas (ya que la energía total del gas y el peso debe conservarse) es decir:
y esta misma energía habrá sido perdida por el gas (ya que la energía total del gas y el peso debe conservarse) es decir:
y por tanto se realiza un trabajo:
,
de donde:
Ya que 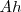 es la variación del volumen
es la variación del volumen 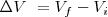 del gas. Además el signo negativo indica que ha habido un incremento del volumen lo que implica una disminución de la energía interna
del gas. Además el signo negativo indica que ha habido un incremento del volumen lo que implica una disminución de la energía interna 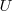 del gas (sistema) es decir un trabajo hecho por el sistema sobre los alrededores.
del gas (sistema) es decir un trabajo hecho por el sistema sobre los alrededores.
En general, si repetimos el proceso quitando sucesivamente pesos al tabique de modo que en cada paso se mantenga el equilibrio de presiones, el trabajo total realizado será
Debe tenerse en cuenta que la presión no se mantiene constante a lo largo del proceso global sino que varía a medida que aumentamos el peso superior y por consiguiente varía el volumen, es decir la presión es una función del volumen.
Para que el trabajo venga expresado en julios (J) la presión debe estar en pascales (Pa) y el volumen en metros cúbico 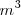 .
.
Si la energía es suministrada al gas del cilindro se invierte en realizar un trabajo contra la presión exterior y en aumentar la energía de las partículas del gas.
En la mayoría de las reacciones químicas, la presión atmosférica se mantiene constante (se realizan en recipientes abiertos); el sistema puede aumentar de volumen, con lo que existe un trabajo de expansión (negativo pues lo realiza el sistema) o puede disminuir el volumen produciéndose un trabajo de comprensión (positivo, pues se realiza sobre el sistema).
El trabajo es otra forma que existe de intercambio entre dos sistemas, es decir otro tipo de energía en transito, y es debido a algún desplazamiento producido por efecto de las fuerzas.