Atomísmo eléctrico
De Wikillerato
| Línea 2: | Línea 2: | ||
===Antecedentes históricos, buscando el mínimo de carga eléctrica=== | ===Antecedentes históricos, buscando el mínimo de carga eléctrica=== | ||
| - | Los fenómenos eléctricos atrajeron la atención de los filósofos griegos, se cuenta que Tales de Mileto, que vivió en esa ciudad Jónica en Asia menor, actual Turquía, en el siglo VII a. C. (considerado el primer filósofo griego), encontró que al frotar el ámbar, este podía atraer pequeños trozos de objetos livianos hechos de paja, papel y otras sustancias. La palabra griega de ámbar es electrón, razón por la cual el ingles Willian Gilbert (1544-1603), un médico de la corte isabelina, hombre de gran genio y visión descubrió que una varilla de vidrio y otros veinte cuerpos, al ser frotados con seda actúan en forma similar al ámbar de los griegos, decidió describir el fenómeno diciendo que la varilla de vidrio se había ''electrificado'' (o sea “ambarizado”), o como lo expresamos ahora había adquirido una '''carga eléctrica'''. En su tratado sobre electricidad y magnetismo ''De magnete'' propuso llamar sustancias '''eléctricas''' a aquellas que tenían la propiedad del ámbar, '''electricidad''' a dicha propiedad y '''eléctrica''' al fenómeno de atracción. | + | Los fenómenos eléctricos atrajeron la atención de los filósofos griegos, se cuenta que '''Tales de Mileto''', que vivió en esa ciudad Jónica en Asia menor, actual Turquía, en el siglo VII a. C. (considerado el primer filósofo griego), encontró que al frotar el ámbar, este podía atraer pequeños trozos de objetos livianos hechos de paja, papel y otras sustancias. La palabra griega de ámbar es electrón, razón por la cual el ingles '''Willian Gilbert''' (1544-1603), un médico de la corte isabelina, hombre de gran genio y visión descubrió que una varilla de vidrio y otros veinte cuerpos, al ser frotados con seda actúan en forma similar al ámbar de los griegos, decidió describir el fenómeno diciendo que la varilla de vidrio se había ''electrificado'' (o sea “ambarizado”), o como lo expresamos ahora había adquirido una '''carga eléctrica'''. En su tratado sobre electricidad y magnetismo ''De magnete'' propuso llamar sustancias '''eléctricas''' a aquellas que tenían la propiedad del ámbar, '''electricidad''' a dicha propiedad y '''eléctrica''' al fenómeno de atracción. |
| - | El físico francés Charles F. Du Fay (1698-1739) , descubrió 1732 que el lacre, la ser frotado con ''piel de gato'', se electrizaba también; pero a diferencia de la varilla de vidrio electrizada atraía fuertemente cualquier cuerpo electrizado que hubiese sido repelido por el vidrio, en tanto que rechazaba cualquier cuerpo electrizado que fuera atraído por el vidrio. Así, llevando a cabo experimentos de electrificación con diferentes sustancias llego al descubrimiento de que hay dos tipos de electricidad: la producida por el ámbar, el lacre, la seda, hilo, papel, o la vulcanita y otras ''sustancias resinosas'' al ser frotadas, y la producida frotando sustancias vítreas como el cristal, la mica, piedras preciosas, lana y pelo de animales. A parir de estos resultados Du Fay reconoció dos "géneros" de electricidad que llamó '''resinosa''' y '''vítrea''', y estableció que dos cuerpos cargados eléctricamente de igual manera (e.g vítrea) se repelen mutuamente mientras que los de género distinto se atraen. | + | El físico francés '''Charles F. Du Fay''' (1698-1739) , descubrió 1732 que el lacre, la ser frotado con ''piel de gato'', se electrizaba también; pero a diferencia de la varilla de vidrio electrizada atraía fuertemente cualquier cuerpo electrizado que hubiese sido repelido por el vidrio, en tanto que rechazaba cualquier cuerpo electrizado que fuera atraído por el vidrio. Así, llevando a cabo experimentos de electrificación con diferentes sustancias llego al descubrimiento de que hay dos tipos de electricidad: la producida por el ámbar, el lacre, la seda, hilo, papel, o la vulcanita y otras ''sustancias resinosas'' al ser frotadas, y la producida frotando sustancias vítreas como el cristal, la mica, piedras preciosas, lana y pelo de animales. A parir de estos resultados Du Fay reconoció dos "géneros" de electricidad que llamó '''resinosa''' y '''vítrea''', y estableció que dos cuerpos cargados eléctricamente de igual manera (e.g vítrea) se repelen mutuamente mientras que los de género distinto se atraen. |
| - | El científico y estadista americano Benjamín Franklin (1706-1790), famoso por ser el inventor del pararayos, alrededor de 1747 reconoció también esas dos clases de electricidad e introdujo los término '''positiva''' y '''negativa''' para distinguirlas. Propuso la teoría de que la electricidad vítrea era la única clase de fluido o “fuego” eléctrico y que los diferentes géneros de electricidad correspondían al exceso o a la falta de este ''fluido imponderable''. Así pues, para él el cuerpo cargado con un exceso de electricidad vítrea (como una varilla de cristal frotado con tela de seda) la llamaba ''cuerpo electrificado positivamente'' mientras que un cuerpo con falta de ella (como una varilla de lacre o caucho frotada con piel de gato) era un ''cuerpo electrificado negativamente''. Franklin supuso también que cuando dos cuerpos uno de los cuales tiene un exceso y el otro una deficiencia de fluido eléctrico (el vítreo) se juntan o ponen en contacto, la corriente eléctrica debe fluir desde el primer cuerpo donde está en exceso al segundo donde falta. En aquel tiempo Franklin no sabia por ejemplo si el fluido eléctrico había sido transferido después de la frotación desde la tela de seda a la varilla de vidreo o a la inversa. No obstante, Franklin asumió de manera arbitraria que la varilla de vidrio al ser frotada adquiere parte del fluido eléctrico (cargandose positivamente con ello) que es transferido desde la tela de seda por el frotamiento, la cual tenía inicialmente un exceso de fluido eléctrico, quedando así la tela después de la transferencia con una deficiencia de fluido eléctrico y por lo tanto estando por ello cargada negativamente, suponiendo además que la carga positiva recibida por el vidrio era igual a la perdida por la tela de seda y en general Franklin asumía que las cargas positivas y negativa aparecen siempre simultáneamente y en cantidades exactamente iguales. | + | El científico y estadista americano '''Benjamín Franklin''' (1706-1790), famoso por ser el inventor del pararayos, alrededor de 1747 reconoció también esas dos clases de electricidad e introdujo los término '''positiva''' y '''negativa''' para distinguirlas. Propuso la teoría de que la electricidad vítrea era la única clase de fluido o “fuego” eléctrico y que los diferentes géneros de electricidad correspondían al exceso o a la falta de este ''fluido imponderable''. Así pues, para él el cuerpo cargado con un exceso de electricidad vítrea (como una varilla de cristal frotado con tela de seda) la llamaba ''cuerpo electrificado positivamente'' mientras que un cuerpo con falta de ella (como una varilla de lacre o caucho frotada con piel de gato) era un ''cuerpo electrificado negativamente''. Franklin supuso también que cuando dos cuerpos uno de los cuales tiene un exceso y el otro una deficiencia de fluido eléctrico (el vítreo) se juntan o ponen en contacto, la corriente eléctrica debe fluir desde el primer cuerpo donde está en exceso al segundo donde falta. En aquel tiempo Franklin no sabia por ejemplo si el fluido eléctrico había sido transferido después de la frotación desde la tela de seda a la varilla de vidreo o a la inversa. No obstante, Franklin asumió de manera arbitraria que la varilla de vidrio al ser frotada adquiere parte del fluido eléctrico (cargandose positivamente con ello) que es transferido desde la tela de seda por el frotamiento, la cual tenía inicialmente un exceso de fluido eléctrico, quedando así la tela después de la transferencia con una deficiencia de fluido eléctrico y por lo tanto estando por ello cargada negativamente, suponiendo además que la carga positiva recibida por el vidrio era igual a la perdida por la tela de seda y en general Franklin asumía que las cargas positivas y negativa aparecen siempre simultáneamente y en cantidades exactamente iguales. |
Ahora conocemos de hecho que Franklin estaba equivocado a este respecto, cuando la varilla de vidrio es frotada con seda partículas negativamente cargadas (electrones), son transferidos desde la varilla a la tela de seda. Sin embargo, las ideas de Franklin han llegado a la terminología moderna en la cual la corriente eléctrica se representa como “fluyendo” del electrodo positivo (ánodo) al negativo (cátodo). | Ahora conocemos de hecho que Franklin estaba equivocado a este respecto, cuando la varilla de vidrio es frotada con seda partículas negativamente cargadas (electrones), son transferidos desde la varilla a la tela de seda. Sin embargo, las ideas de Franklin han llegado a la terminología moderna en la cual la corriente eléctrica se representa como “fluyendo” del electrodo positivo (ánodo) al negativo (cátodo). | ||
| - | El físico Robert Simmer (1707-1763) siguiendo la estela de las ideas del científico alemán Franz T. Aepenius (1724-1802) en 1759 defendió a diferencia de la teoría de fluido eléctrico único de Franklin la existencia de dos fluidos eléctricos diferentes como responsables de los dos tipos de electricidades resinosa y vítrea. Prefiriendo con ello suponer que la materia en ''estado neutro'' no muestra propiedades eléctricas por contener como componentes cantidades iguales de electricidad positiva y negativa. Desde ese punto de vista un cuerpo cargado positivamente es aquel que tiene mayor cantidad de fluido positivo que negativo y un cuerpo cargado negativamente es aquel en el cual el fluido negativo está en exceso. | + | El físico '''Robert Simmer''' (1707-1763) siguiendo la estela de las ideas del científico alemán Franz T. Aepenius (1724-1802) en 1759 defendió a diferencia de la teoría de fluido eléctrico único de Franklin la existencia de dos fluidos eléctricos diferentes como responsables de los dos tipos de electricidades resinosa y vítrea. Prefiriendo con ello suponer que la materia en ''estado neutro'' no muestra propiedades eléctricas por contener como componentes cantidades iguales de electricidad positiva y negativa. Desde ese punto de vista un cuerpo cargado positivamente es aquel que tiene mayor cantidad de fluido positivo que negativo y un cuerpo cargado negativamente es aquel en el cual el fluido negativo está en exceso. |
Franklin propuso también, “La materia eléctrica se halla compuesta de partículas extremadamente sutiles dado que pueden penetrar la materia común, aun la más densa, con tal libertad y facilidad como para no encontrar ninguna resistencia apreciable ...” en esa fecha la teoría atómica de la electricidad era lo que la teoría atómica de la materia fue para Demócrito, pura especulación (a). | Franklin propuso también, “La materia eléctrica se halla compuesta de partículas extremadamente sutiles dado que pueden penetrar la materia común, aun la más densa, con tal libertad y facilidad como para no encontrar ninguna resistencia apreciable ...” en esa fecha la teoría atómica de la electricidad era lo que la teoría atómica de la materia fue para Demócrito, pura especulación (a). | ||
| Línea 18: | Línea 18: | ||
===Iones: Electroquímica=== | ===Iones: Electroquímica=== | ||
| - | La naturaleza eléctrica de las sustancias químicas fue advertida inmediatamente después de que en 1791 el médico, fisiólogo y químico italiano Luigi Galvani (1737-1798) comprobara el efecto de la electricidad sobre los nervios y los músculos de una anca de rana, por el físico también italiano Alessandro Volta (1745- 1827, amigo personal de Galvani) al construir el primer generador eléctrico, a partir de una batería de pilas eléctricas o pilas de Volta, (construidas con una pila de discos de metal alternados de cobre y de hierro o cinc separados en capas con paños impregnados con agua salada) , pues con ello encontró que las reacciones químicas podían producir electricidad. El fenómeno contrario que una corriente eléctrica podía producir transformaciones (reacciones) químicas fue descubierto por el químico inglés Sir Humphry Davy (1778-1829), el 6 de Octubre de 1807 al hacer pasar una corriente a través de potasa fundida (carbonato cálcico) observó que se liberaban pequeños glóbulos de un metal muy activo que llamó ''potasio'', una semana después Davy aisló el ''sodio'' a partir de esa misma solución. Con este método electrolítico descubrió otros metales a partir de sales fundidas de sus óxidos: ''magnesio'' de la magnesia, ''estroncio'' de la estroncita, ''bario'' de la baritina, ''calcio'' de la calcita. Identificó también al cloro como un elemento, a partir del ácido clorhídrico. | + | La naturaleza eléctrica de las sustancias químicas fue advertida inmediatamente después de que en 1791 el médico, fisiólogo y químico italiano '''Luigi Galvani''' (1737-1798) comprobara el efecto de la electricidad sobre los nervios y los músculos de una anca de rana, por el físico también italiano Alessandro Volta (1745- 1827, amigo personal de Galvani) al construir el primer generador eléctrico, a partir de una batería de pilas eléctricas o pilas de Volta, (construidas con una pila de discos de metal alternados de cobre y de hierro o cinc separados en capas con paños impregnados con agua salada) , pues con ello encontró que las reacciones químicas podían producir electricidad. El fenómeno contrario que una corriente eléctrica podía producir transformaciones (reacciones) químicas fue descubierto por el químico inglés '''Sir Humphry Davy''' (1778-1829), el 6 de Octubre de 1807 al hacer pasar una corriente a través de potasa fundida (carbonato cálcico) observó que se liberaban pequeños glóbulos de un metal muy activo que llamó ''potasio'', una semana después Davy aisló el ''sodio'' a partir de esa misma solución. Con este método electrolítico descubrió otros metales a partir de sales fundidas de sus óxidos: ''magnesio'' de la magnesia, ''estroncio'' de la estroncita, ''bario'' de la baritina, ''calcio'' de la calcita. Identificó también al cloro como un elemento, a partir del ácido clorhídrico. |
| - | El estudio de estos procesos electrolíticos produjeron el primer indicio experimental a favor de una idea cuantizada (discreta) de la carga eléctrica (como hemos visto anteriormente propuesta de manera especulativa por Benjamin Franklin) surgió con el trabajo experimental del protegido y ayudante de Davy, el gran científico Michel Faraday (1791-1867) que llevo a cabo (en los primeros años del siglo XIX) sobre la conducción de la electricidad en líquidos. Por otra parte, Faraday acuñó los términos electrolisis, para indicar el proceso de ruptura (del griego ''lisis'', romper) de las moléculas por la electricidad. '''Electrolito''' a los compuestos o soluciones capaces de transportar una corriente eléctrica. A las placas o varillas del metal introducidas en la sustancia fundida o solución (generalmente acuosas) de ciertos compuestos principalmente inorgánicos recibieron el nombre de '''electrodos'''; al el electrodo que llevaba una carga positiva le llamó '''ánodo''', el que llevaba una carga negativa era el '''cátodo'''. Algunos de estos términos le fueron sugeridos por su amigo William Whewell (1794–1866).Su propuesta de la ley de la electrólisis, fue de gran importancia para entender la naturaleza de las fuerzas eléctrica, y los constituyentes eléctricos del átomo. | + | El estudio de estos procesos electrolíticos produjeron el primer indicio experimental a favor de una idea cuantizada (discreta) de la carga eléctrica (como hemos visto anteriormente propuesta de manera especulativa por Benjamin Franklin) surgió con el trabajo experimental del protegido y ayudante de Davy, el gran científico '''Michel Faraday''' (1791-1867) que llevo a cabo (en los primeros años del siglo XIX) sobre la conducción de la electricidad en líquidos. Por otra parte, Faraday acuñó los términos electrolisis, para indicar el proceso de ruptura (del griego ''lisis'', romper) de las moléculas por la electricidad. '''Electrolito''' a los compuestos o soluciones capaces de transportar una corriente eléctrica. A las placas o varillas del metal introducidas en la sustancia fundida o solución (generalmente acuosas) de ciertos compuestos principalmente inorgánicos recibieron el nombre de '''electrodos'''; al el electrodo que llevaba una carga positiva le llamó '''ánodo''', el que llevaba una carga negativa era el '''cátodo'''. Algunos de estos términos le fueron sugeridos por su amigo William Whewell (1794–1866).Su propuesta de la ley de la electrólisis, fue de gran importancia para entender la naturaleza de las fuerzas eléctrica, y los constituyentes eléctricos del átomo. |
En sus experimentos Faraday hacia pasar una corriente eléctrica a través de soluciones líquidas ligeramente conductoras y observaba la subsecuente liberación de los componentes de la solución en los electrodos de su cubeta de electrólisis. "En 1833, Faraday descubrió que el pasaje de una cantidad de electricidad dada a través de una solución que contiene un compuesto de hidrógeno, por ejemplo, produce siempre la aparición, en el electrodo negativo (cátodo), de igual cantidad de gas de hidrógeno, independientemente de cual sea el compuesto de hidrógeno que haya sido disuelto e independientemente también de la concentración de la solución, y que además la cantidad de electricidad necesaria para producir un gramo de hidrógeno deposita siempre, en una solución que contiene plata exactamente 107.5 g de plata. Esto significa que dado que el peso del átomo de plata es exactamente 107.5 veces el peso del átomo de hidrógeno, el peso de hidrógeno y el átomo de plata se encuentran asociados en las soluciones exactamente a la misma cantidad de electricidad. Faraday descubrió así que de ese modo todos los átomos que son monovalentes en Química, es to es, que se combina con un átomo de hidrógeno (e.g. cloruro de hidrógeno) llevan precisamente la misma cantidad de electricidad , y que todo los átomos Bivalente se llevan el doble de esta cantidad, y que en general, la valencia, en Química es siempre exactamente proporcional a la cantidad de electricidad llevada por el átomo en cuestión" (b). | En sus experimentos Faraday hacia pasar una corriente eléctrica a través de soluciones líquidas ligeramente conductoras y observaba la subsecuente liberación de los componentes de la solución en los electrodos de su cubeta de electrólisis. "En 1833, Faraday descubrió que el pasaje de una cantidad de electricidad dada a través de una solución que contiene un compuesto de hidrógeno, por ejemplo, produce siempre la aparición, en el electrodo negativo (cátodo), de igual cantidad de gas de hidrógeno, independientemente de cual sea el compuesto de hidrógeno que haya sido disuelto e independientemente también de la concentración de la solución, y que además la cantidad de electricidad necesaria para producir un gramo de hidrógeno deposita siempre, en una solución que contiene plata exactamente 107.5 g de plata. Esto significa que dado que el peso del átomo de plata es exactamente 107.5 veces el peso del átomo de hidrógeno, el peso de hidrógeno y el átomo de plata se encuentran asociados en las soluciones exactamente a la misma cantidad de electricidad. Faraday descubrió así que de ese modo todos los átomos que son monovalentes en Química, es to es, que se combina con un átomo de hidrógeno (e.g. cloruro de hidrógeno) llevan precisamente la misma cantidad de electricidad , y que todo los átomos Bivalente se llevan el doble de esta cantidad, y que en general, la valencia, en Química es siempre exactamente proporcional a la cantidad de electricidad llevada por el átomo en cuestión" (b). | ||
| Línea 55: | Línea 55: | ||
Expresada de este modo la ley de faraday dice que una carga eléctrica F es transportada al electrodo en una cubeta electrolítica cuando un mol de un ion cargado monavalentemente con masa <math>x</math> y carga elementaria <math>e</math> ha sido depositado en el electrodo. Por lo tanto pesando el electrodo después de que una carga F se haya transferido producirá <math>N_A</math>. Así el cociente entre la cantidad de carga de un faraday (F) y el número de Avogadro nos daría la cantidad de electricidad transportada por cada átomo o radical monovalente.Ya que el faraday <math>F</math> se podía medir con bastante precisión, <math>N_A</math> o <math>e</math> podía ser determinado si el otro era conocido. Faraday era consciente de ello pero no pudo determinar ninguna de esas dos cantidades. No obstante, esta ley electrolítica ofrecía una prueba bastante concluyente de la existencia de las moléculas químicas propuestas por Avogadro y que estas constan de átomos. Demostraba además que la carga está cuantizada porque a los electrodos solo se transfieren números enteros de carga. Apuntaba también la posibilidad de que los átomos estaban formados por elementos constituyentes cargados positivamente y negativamente, aunque en ese momento la entidad de los mismos permanecía desconocida. Parecía así que la carga eléctrica al igual que la idea atómica de la constitución de la materia parecia no ser continua sino constituida de partículas portadoras de una cantidad discreta de carga eléctrica. | Expresada de este modo la ley de faraday dice que una carga eléctrica F es transportada al electrodo en una cubeta electrolítica cuando un mol de un ion cargado monavalentemente con masa <math>x</math> y carga elementaria <math>e</math> ha sido depositado en el electrodo. Por lo tanto pesando el electrodo después de que una carga F se haya transferido producirá <math>N_A</math>. Así el cociente entre la cantidad de carga de un faraday (F) y el número de Avogadro nos daría la cantidad de electricidad transportada por cada átomo o radical monovalente.Ya que el faraday <math>F</math> se podía medir con bastante precisión, <math>N_A</math> o <math>e</math> podía ser determinado si el otro era conocido. Faraday era consciente de ello pero no pudo determinar ninguna de esas dos cantidades. No obstante, esta ley electrolítica ofrecía una prueba bastante concluyente de la existencia de las moléculas químicas propuestas por Avogadro y que estas constan de átomos. Demostraba además que la carga está cuantizada porque a los electrodos solo se transfieren números enteros de carga. Apuntaba también la posibilidad de que los átomos estaban formados por elementos constituyentes cargados positivamente y negativamente, aunque en ese momento la entidad de los mismos permanecía desconocida. Parecía así que la carga eléctrica al igual que la idea atómica de la constitución de la materia parecia no ser continua sino constituida de partículas portadoras de una cantidad discreta de carga eléctrica. | ||
| - | Considerando las experiencias de Faraday ,el científico irlandés George Johnstone Stoney (1826-1911) sugirió en una comunicación publicada en 1891 el nombre de electrón (abreviadamente <math>e</math>) para la “unidad natural de la electricidad” o sea la mínima cantidad de electricidad (o cantidad de carga), que debe pasar a través de una solución para poner en libertad, en uno de sus electrodos, un átomo de hidrógeno o un átomo de cualquier sustancia simple formada por un elemento monovalente. En esa comunicación decía Johnstone ...”por lo tanto pueden existir varias de estas cargas en un átomo químico, y al parecer, hay por lo menos dos en cada átomo. Estas cargas, que serán conviene llamar “electrones”, no pueden ser sacadas del átomo, sino que se disimulan cuando los átomos se unen químicamente...” (b) . Además usando una estima obtenida para <math>N_A</math> a partir de la [[teoría cinética de los gases]] G.J. Stoney pudo computar utilizando la ecuación el valor de e de aproximadamente <math>10^{-20} C</math>. Después de que J. J. Thomson descubriera la partícula (“corpúsculos” en la terminología original de Thomson) que lleva o porta la unidad fundamental de carga, el nombre de electrón fue transferido por el gran físico holandés Hendrik A. Lorentz (1853-1928) desde la cantidad de carga para desiganar con el nombre de '''electrones''' a los corpúsculos de Thomson. | + | Considerando las experiencias de Faraday ,el científico irlandés '''George Johnstone Stoney''' (1826-1911) sugirió en una comunicación publicada en 1891 el nombre de electrón (abreviadamente <math>e</math>) para la “unidad natural de la electricidad” o sea la mínima cantidad de electricidad (o cantidad de carga), que debe pasar a través de una solución para poner en libertad, en uno de sus electrodos, un átomo de hidrógeno o un átomo de cualquier sustancia simple formada por un elemento monovalente. En esa comunicación decía Johnstone ...”por lo tanto pueden existir varias de estas cargas en un átomo químico, y al parecer, hay por lo menos dos en cada átomo. Estas cargas, que serán conviene llamar “electrones”, no pueden ser sacadas del átomo, sino que se disimulan cuando los átomos se unen químicamente...” (b) . Además usando una estima obtenida para <math>N_A</math> a partir de la [[teoría cinética de los gases]] G.J. Stoney pudo computar utilizando la ecuación el valor de e de aproximadamente <math>10^{-20} C</math>. Después de que J. J. Thomson descubriera la partícula (“corpúsculos” en la terminología original de Thomson) que lleva o porta la unidad fundamental de carga, el nombre de electrón fue transferido por el gran físico holandés Hendrik A. Lorentz (1853-1928) desde la cantidad de carga para desiganar con el nombre de '''electrones''' a los corpúsculos de Thomson. |
===Tubos de descargas: rayos catódicos y canales=== | ===Tubos de descargas: rayos catódicos y canales=== | ||
| - | Hacia finales del siglo XIX, los físicos centraron su atención a el paso de la electricidad por los gases, se sabia desde hacia mucho tiempo que los gases de ordinario son unos [[aislantes eléctricos]] bastantes buenos, aunque pueden ser atravesadas a veces por tensiones eléctricas elevadas (como ocurre en los rayos que son producidos en las tormentas eléctricas). El físico inglés Sir Willian Crookes (1832 -1919) descubrió que el paso de la corriente eléctrica a través de un gas encerrado en un tubo de cristal de tipo Geissler (tubos experimentales construidos en el siglo XIX por el físico y soplador de vidrio J.H.W. Geissler, 1814 - 1879, predecesores de los modernos tubos fluorescentes) se producía más fácilmente a través de un gas si se reducía la presión de este dentro del tubo a una pequeña fracción de una atmósfera. El perfeccionamiento de las bombas de vacío por difusión de mercurio, permitía obtener vacíos por debajo de <math>10^{-6} </math> atmósferas (atm) fue un aspecto clave en el estudio de la descarga eléctrica en estos tubos. | + | Hacia finales del siglo XIX, los físicos centraron su atención a el paso de la electricidad por los gases, se sabia desde hacia mucho tiempo que los gases de ordinario son unos [[aislantes eléctricos]] bastantes buenos, aunque pueden ser atravesadas a veces por tensiones eléctricas elevadas (como ocurre en los rayos que son producidos en las tormentas eléctricas). El físico inglés '''Sir Willian Crookes''' (1832 -1919) descubrió que el paso de la corriente eléctrica a través de un gas encerrado en un tubo de cristal de tipo Geissler (tubos experimentales construidos en el siglo XIX por el físico y soplador de vidrio '''J.H.W. Geissler''', 1814 - 1879, predecesores de los modernos tubos fluorescentes) se producía más fácilmente a través de un gas si se reducía la presión de este dentro del tubo a una pequeña fracción de una atmósfera. El perfeccionamiento de las bombas de vacío por difusión de mercurio, permitía obtener vacíos por debajo de <math>10^{-6} </math> atmósferas (atm) fue un aspecto clave en el estudio de la descarga eléctrica en estos tubos. |
Por ejemplo, se puede observar que si entre los electrodos de un tubo de Crookes se aplica una [[diferencia de potencial]] de 10000 voltios (V) ninguna descarga eléctrica ocurre hasta que parte del gas es evacuado (bombeado) fuera del tubo. La naturaleza de la descarga la cual esta asociada con la emisión de luz por el gas en el tubo cambia a medida que la presión desciende. Así, se observa que la descarga eléctrica comienza a ocurrir cuando la presión del gas del interior del tubo desciende por debajo de 0.01 atmóferas. A esta presión el transporte de electricidad tiene lugar a través del gas mostrado por el flujo de una corriente eléctrica entre los electrodos del circuito exterior, y el gas aparece entonces luminoso. Si se sigue evacuando gas del tubo, y la presión es menor de 0.001 atm un espacio oscuro (llamado ''espacio oscuro de Crookes'') aparece en las cercanías del cátodo y unas estriaciones brillantes son observadas a lo largo del resto del tubo. A presiones aún más bajas <math>10^{-5}</math> atmosferas (atm) el tamaño del espacio oscuro se incrementa , y a una presión de <math>10^{-6}</math> a <math>5x10^{-8} </math> atm ocupa todo el conjunto del tubo. A esta baja presión ninguna luz es emitida por el gas residual contenido todavía en el tubo, la luminiscencia pues del gas desaparece, pero aparece entonces perfectamente definido un haz que va del cátodo al ánodo y que choca contra el cristal de las paredes del extremo del tubo de descarga, el cual entonces resplandece (fluoresce) con una luz difusa ligeramente amarillenta-verdosa | Por ejemplo, se puede observar que si entre los electrodos de un tubo de Crookes se aplica una [[diferencia de potencial]] de 10000 voltios (V) ninguna descarga eléctrica ocurre hasta que parte del gas es evacuado (bombeado) fuera del tubo. La naturaleza de la descarga la cual esta asociada con la emisión de luz por el gas en el tubo cambia a medida que la presión desciende. Así, se observa que la descarga eléctrica comienza a ocurrir cuando la presión del gas del interior del tubo desciende por debajo de 0.01 atmóferas. A esta presión el transporte de electricidad tiene lugar a través del gas mostrado por el flujo de una corriente eléctrica entre los electrodos del circuito exterior, y el gas aparece entonces luminoso. Si se sigue evacuando gas del tubo, y la presión es menor de 0.001 atm un espacio oscuro (llamado ''espacio oscuro de Crookes'') aparece en las cercanías del cátodo y unas estriaciones brillantes son observadas a lo largo del resto del tubo. A presiones aún más bajas <math>10^{-5}</math> atmosferas (atm) el tamaño del espacio oscuro se incrementa , y a una presión de <math>10^{-6}</math> a <math>5x10^{-8} </math> atm ocupa todo el conjunto del tubo. A esta baja presión ninguna luz es emitida por el gas residual contenido todavía en el tubo, la luminiscencia pues del gas desaparece, pero aparece entonces perfectamente definido un haz que va del cátodo al ánodo y que choca contra el cristal de las paredes del extremo del tubo de descarga, el cual entonces resplandece (fluoresce) con una luz difusa ligeramente amarillenta-verdosa | ||
| - | El físico y matemático alemán Julius Plücker usando un tubo de Geissler-Crookes fue el primero que observo rayos catódicos en 1859. En 1876 el físico alemán Goldstein consiguió probar que los rayos provenían del cátodo, y los nombró por ellos rayos catódicos (en alemán ''lkathodenstrahlen''), para significar el hecho de que emanaban del cátodo del tubo de descarga, y el tubo donde se producía recibió el nombre de tubos de rayos catódicos. El físico alemán Johann Wilhelm Hittorf (1834-1914), observó en 1869 que los rayos de que emanaban a partir del cátodo seguían lineas rectas lo cual pudo ser probado por la sombra bien definida que se producida en una pantalla fluorescente cuando un obstáculo fue interpuesto en la vía de los rayos catódicos. El físico francés Jean. B. Perrin (1870-1942) en 1895, fue capaz de demostrar que los rayos eran deviados por un campo magnético y introdujo en el tubo de descarga un cubierta con una ranura, de tal manera que le permitió formar un fino haz de rayos catódicos, situó además una pantalla fluorecescente en el tubo para seguir la trayectoria del haz por la traza dejada de fluorescencia. Cuando situó un imán cerca del tubo de tal manera que las lineas de fuerza del campo magnético fueran perpendiculares a la dirección del movimiento de los rayos catódicos el haz fue observado que se desviaba. A partir del hecho de que los rayos catódicos podían ser desviados por campos magnéticos, Perrin concluyo correctamente que los mismos debían de ser partículas cargadas y a partir de la dirección de desviación concluyo que eran partículas cargadas negativamente. Además, Perrin confirmó adicionalmente este hecho al observar que los rayos catódicos depositaban carga negativa en un aparato denominado electrómetro. Perrin obtuvo el premio Nobel en 1905 por sus trabajos en rayos catódicos. | + | El físico y matemático alemán '''Julius Plücker''' usando un tubo de Geissler-Crookes fue el primero que observo rayos catódicos en 1859. En 1876 el físico alemán Goldstein consiguió probar que los rayos provenían del cátodo, y los nombró por ellos rayos catódicos (en alemán ''lkathodenstrahlen''), para significar el hecho de que emanaban del cátodo del tubo de descarga, y el tubo donde se producía recibió el nombre de tubos de rayos catódicos. El físico alemán '''Johann Wilhelm Hittorf''' (1834-1914), observó en 1869 que los rayos de que emanaban a partir del cátodo seguían lineas rectas lo cual pudo ser probado por la sombra bien definida que se producida en una pantalla fluorescente cuando un obstáculo fue interpuesto en la vía de los rayos catódicos. El físico francés '''Jean. B. Perrin''' (1870-1942) en 1895, fue capaz de demostrar que los rayos eran deviados por un campo magnético y introdujo en el tubo de descarga un cubierta con una ranura, de tal manera que le permitió formar un fino haz de rayos catódicos, situó además una pantalla fluorecescente en el tubo para seguir la trayectoria del haz por la traza dejada de fluorescencia. Cuando situó un imán cerca del tubo de tal manera que las lineas de fuerza del campo magnético fueran perpendiculares a la dirección del movimiento de los rayos catódicos el haz fue observado que se desviaba. A partir del hecho de que los rayos catódicos podían ser desviados por campos magnéticos, Perrin concluyo correctamente que los mismos debían de ser partículas cargadas y a partir de la dirección de desviación concluyo que eran partículas cargadas negativamente. Además, Perrin confirmó adicionalmente este hecho al observar que los rayos catódicos depositaban carga negativa en un aparato denominado electrómetro. Perrin obtuvo el premio Nobel en 1905 por sus trabajos en rayos catódicos. |
| - | Hasta ese momento, todo parecía indicar que estas partículas deben estar cargadas negativamente al pasar a través del gas enrarecido, de la misma manera que Faraday imaginaba que los iones se mueven a través de los líquidos en el proceso de electrólisis. La diferencia esencial era desde luego, que mientras en el caso de la electrólisis los iones tienen que abrirse su camino lentamente a través de las moléculas estrechamente apretadas del líquido y nunca pierden su rumbo opuesto, los rayos catódicos en los gases enrarecidos siguen la línea recta y chocan con cualquier cosa interpuesta en su trayectoria. Además, se pudo demostrar que los constituyentes de esos rayos deberían tener masa pues eran capaces de mover las paletas de un pequeño molinillo puesto en su camino. Así, al final del siglo XIX había físicos que defendían la naturaleza corpuscular de los rayos catódicos, es decir que los mismos se encontraban constituidos de partículas con carga negativa, no obstante otros científicos destacados de la época como Philipp Lenard (1862-1947) no estaba de acuerdo esa interpretación particular para la naturaleza de los rayos catódicos, pues pensaban que los mismo podía ser algún tipo de radiación electromagnética o de algún tipo de vibración del ''éter'' del por aquel entonces hipotético medio en el que se suponían vibraran las ondas electromagnéticas. | + | Hasta ese momento, todo parecía indicar que estas partículas deben estar cargadas negativamente al pasar a través del gas enrarecido, de la misma manera que Faraday imaginaba que los iones se mueven a través de los líquidos en el proceso de electrólisis. La diferencia esencial era desde luego, que mientras en el caso de la electrólisis los iones tienen que abrirse su camino lentamente a través de las moléculas estrechamente apretadas del líquido y nunca pierden su rumbo opuesto, los rayos catódicos en los gases enrarecidos siguen la línea recta y chocan con cualquier cosa interpuesta en su trayectoria. Además, se pudo demostrar que los constituyentes de esos rayos deberían tener masa pues eran capaces de mover las paletas de un pequeño molinillo puesto en su camino. Así, al final del siglo XIX había físicos que defendían la naturaleza corpuscular de los rayos catódicos, es decir que los mismos se encontraban constituidos de partículas con carga negativa, no obstante otros científicos destacados de la época como '''Philipp Lenard''' (1862-1947) no estaba de acuerdo esa interpretación particular para la naturaleza de los rayos catódicos, pues pensaban que los mismo podía ser algún tipo de radiación electromagnética o de algún tipo de vibración del ''éter'' del por aquel entonces hipotético medio en el que se suponían vibraran las ondas electromagnéticas. |
Los experimentos cuantitiativos precisos de la relación carga-masa <math>e/m</math> de los rayos catódicos proporcionaron al científico inglés J.J. Thomson la la primera evidencia experimental clara de que los rayos catódicos consisten de partículas muchos más ligeros que los átomos, y obtuvo por ello todo el crédito del descubrimiento de los electrones. | Los experimentos cuantitiativos precisos de la relación carga-masa <math>e/m</math> de los rayos catódicos proporcionaron al científico inglés J.J. Thomson la la primera evidencia experimental clara de que los rayos catódicos consisten de partículas muchos más ligeros que los átomos, y obtuvo por ello todo el crédito del descubrimiento de los electrones. | ||
| Línea 73: | Línea 73: | ||
El científico inglés Sir '''Joseph John Thomson''' (1856-1940), conocido como “(J.J)” Thomson a finales del siglo XIX (entonces director del famoso laboratorio Cavendish de la Universidad de Cambridge), determinó de una manera directa la relación <math>e/m</math> de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos. | El científico inglés Sir '''Joseph John Thomson''' (1856-1940), conocido como “(J.J)” Thomson a finales del siglo XIX (entonces director del famoso laboratorio Cavendish de la Universidad de Cambridge), determinó de una manera directa la relación <math>e/m</math> de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos. | ||
| - | El instrumento que J.J | + | El instrumento que J.J Thomson empleó para determinar la relación carga-masa (<math>e/m</math>) de los rayos catódicos es el precursor de los actuales tubos de televisión, del osciloscopio, de las pantallas de radar, etc.... El aparato consistía en un tubo de descarga de vidrio en el que se había hecho un vacío elevado, disponiendo en su interior de varios electrodos metálicos (cátodo, ánodo), dos ánodos de colimación (A1 y A2) que permiten generar un fino haz de rayos catódicos, los cuales son acelerados por la aplicación de un alto voltaje entre cátodo y el ánodo, pasando los mismos entre dos placas paralelas construidas en el tubo. La aplicación de un voltaje a esas placas produce un campo eléctrico (<math>\vec E</math>) y con un imán se produce un campo magnético (<math>\vec B</math>) en dirección perpendicular al campo eléctrico; como veremos posteriormente este ordenamiento actúa como un selector de velocidad. Situada en el extremo opuesto del tubo se situaba una pantalla fluorescente de sulfuro de zinc, para detectar el punto de incidencia del haz de rayos catódicos, pudiendo medir con ello la desviación de su trayectoria rectilínea. |
Veamos como utilizando este aparato J.J. Thomson determinó experimental mente la relación carga-masa del electrón | Veamos como utilizando este aparato J.J. Thomson determinó experimental mente la relación carga-masa del electrón | ||
| Línea 150: | Línea 150: | ||
El átomo químico indivisible de Dalton empezaba a ser sustituido por un átomo físico que posee una estructura interna. La medida directa de la relación <math>e/m</math> de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos. | El átomo químico indivisible de Dalton empezaba a ser sustituido por un átomo físico que posee una estructura interna. La medida directa de la relación <math>e/m</math> de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos. | ||
| - | El siguiente hito en el estudio del electrón fue la determinación cuantitativa de la masa (<math>m_e</math>) y la carga eléctrica <math>e</math> portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano Robert. A. Millikan (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga <math>e</math>. | + | El siguiente hito en el estudio del electrón fue la determinación cuantitativa de la masa (<math>m_e</math>) y la carga eléctrica <math>e</math> portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano '''Robert. A. Millikan''' (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga <math>e</math>. |
===Modelo de atómico de Thomson=== | ===Modelo de atómico de Thomson=== | ||
Revisión de 17:08 10 dic 2008
Tabla de contenidos |
Atomismo eléctrico
Antecedentes históricos, buscando el mínimo de carga eléctrica
Los fenómenos eléctricos atrajeron la atención de los filósofos griegos, se cuenta que Tales de Mileto, que vivió en esa ciudad Jónica en Asia menor, actual Turquía, en el siglo VII a. C. (considerado el primer filósofo griego), encontró que al frotar el ámbar, este podía atraer pequeños trozos de objetos livianos hechos de paja, papel y otras sustancias. La palabra griega de ámbar es electrón, razón por la cual el ingles Willian Gilbert (1544-1603), un médico de la corte isabelina, hombre de gran genio y visión descubrió que una varilla de vidrio y otros veinte cuerpos, al ser frotados con seda actúan en forma similar al ámbar de los griegos, decidió describir el fenómeno diciendo que la varilla de vidrio se había electrificado (o sea “ambarizado”), o como lo expresamos ahora había adquirido una carga eléctrica. En su tratado sobre electricidad y magnetismo De magnete propuso llamar sustancias eléctricas a aquellas que tenían la propiedad del ámbar, electricidad a dicha propiedad y eléctrica al fenómeno de atracción.
El físico francés Charles F. Du Fay (1698-1739) , descubrió 1732 que el lacre, la ser frotado con piel de gato, se electrizaba también; pero a diferencia de la varilla de vidrio electrizada atraía fuertemente cualquier cuerpo electrizado que hubiese sido repelido por el vidrio, en tanto que rechazaba cualquier cuerpo electrizado que fuera atraído por el vidrio. Así, llevando a cabo experimentos de electrificación con diferentes sustancias llego al descubrimiento de que hay dos tipos de electricidad: la producida por el ámbar, el lacre, la seda, hilo, papel, o la vulcanita y otras sustancias resinosas al ser frotadas, y la producida frotando sustancias vítreas como el cristal, la mica, piedras preciosas, lana y pelo de animales. A parir de estos resultados Du Fay reconoció dos "géneros" de electricidad que llamó resinosa y vítrea, y estableció que dos cuerpos cargados eléctricamente de igual manera (e.g vítrea) se repelen mutuamente mientras que los de género distinto se atraen.
El científico y estadista americano Benjamín Franklin (1706-1790), famoso por ser el inventor del pararayos, alrededor de 1747 reconoció también esas dos clases de electricidad e introdujo los término positiva y negativa para distinguirlas. Propuso la teoría de que la electricidad vítrea era la única clase de fluido o “fuego” eléctrico y que los diferentes géneros de electricidad correspondían al exceso o a la falta de este fluido imponderable. Así pues, para él el cuerpo cargado con un exceso de electricidad vítrea (como una varilla de cristal frotado con tela de seda) la llamaba cuerpo electrificado positivamente mientras que un cuerpo con falta de ella (como una varilla de lacre o caucho frotada con piel de gato) era un cuerpo electrificado negativamente. Franklin supuso también que cuando dos cuerpos uno de los cuales tiene un exceso y el otro una deficiencia de fluido eléctrico (el vítreo) se juntan o ponen en contacto, la corriente eléctrica debe fluir desde el primer cuerpo donde está en exceso al segundo donde falta. En aquel tiempo Franklin no sabia por ejemplo si el fluido eléctrico había sido transferido después de la frotación desde la tela de seda a la varilla de vidreo o a la inversa. No obstante, Franklin asumió de manera arbitraria que la varilla de vidrio al ser frotada adquiere parte del fluido eléctrico (cargandose positivamente con ello) que es transferido desde la tela de seda por el frotamiento, la cual tenía inicialmente un exceso de fluido eléctrico, quedando así la tela después de la transferencia con una deficiencia de fluido eléctrico y por lo tanto estando por ello cargada negativamente, suponiendo además que la carga positiva recibida por el vidrio era igual a la perdida por la tela de seda y en general Franklin asumía que las cargas positivas y negativa aparecen siempre simultáneamente y en cantidades exactamente iguales.
Ahora conocemos de hecho que Franklin estaba equivocado a este respecto, cuando la varilla de vidrio es frotada con seda partículas negativamente cargadas (electrones), son transferidos desde la varilla a la tela de seda. Sin embargo, las ideas de Franklin han llegado a la terminología moderna en la cual la corriente eléctrica se representa como “fluyendo” del electrodo positivo (ánodo) al negativo (cátodo).
El físico Robert Simmer (1707-1763) siguiendo la estela de las ideas del científico alemán Franz T. Aepenius (1724-1802) en 1759 defendió a diferencia de la teoría de fluido eléctrico único de Franklin la existencia de dos fluidos eléctricos diferentes como responsables de los dos tipos de electricidades resinosa y vítrea. Prefiriendo con ello suponer que la materia en estado neutro no muestra propiedades eléctricas por contener como componentes cantidades iguales de electricidad positiva y negativa. Desde ese punto de vista un cuerpo cargado positivamente es aquel que tiene mayor cantidad de fluido positivo que negativo y un cuerpo cargado negativamente es aquel en el cual el fluido negativo está en exceso.
Franklin propuso también, “La materia eléctrica se halla compuesta de partículas extremadamente sutiles dado que pueden penetrar la materia común, aun la más densa, con tal libertad y facilidad como para no encontrar ninguna resistencia apreciable ...” en esa fecha la teoría atómica de la electricidad era lo que la teoría atómica de la materia fue para Demócrito, pura especulación (a).
Aunque hoy sabemos que hay tanto partículas cargadas negativamente (electrones) como positivamente (protones), que portan la cantidad minina de carga eléctrica. El camino teórico y experimental que condujo al descubrimento de esas partículas, así como de la cuantización de la carga eléctrica ocupó a los físicos y químicos en los años finales del siglo XIX y primeros años del XX.
Iones: Electroquímica
La naturaleza eléctrica de las sustancias químicas fue advertida inmediatamente después de que en 1791 el médico, fisiólogo y químico italiano Luigi Galvani (1737-1798) comprobara el efecto de la electricidad sobre los nervios y los músculos de una anca de rana, por el físico también italiano Alessandro Volta (1745- 1827, amigo personal de Galvani) al construir el primer generador eléctrico, a partir de una batería de pilas eléctricas o pilas de Volta, (construidas con una pila de discos de metal alternados de cobre y de hierro o cinc separados en capas con paños impregnados con agua salada) , pues con ello encontró que las reacciones químicas podían producir electricidad. El fenómeno contrario que una corriente eléctrica podía producir transformaciones (reacciones) químicas fue descubierto por el químico inglés Sir Humphry Davy (1778-1829), el 6 de Octubre de 1807 al hacer pasar una corriente a través de potasa fundida (carbonato cálcico) observó que se liberaban pequeños glóbulos de un metal muy activo que llamó potasio, una semana después Davy aisló el sodio a partir de esa misma solución. Con este método electrolítico descubrió otros metales a partir de sales fundidas de sus óxidos: magnesio de la magnesia, estroncio de la estroncita, bario de la baritina, calcio de la calcita. Identificó también al cloro como un elemento, a partir del ácido clorhídrico.
El estudio de estos procesos electrolíticos produjeron el primer indicio experimental a favor de una idea cuantizada (discreta) de la carga eléctrica (como hemos visto anteriormente propuesta de manera especulativa por Benjamin Franklin) surgió con el trabajo experimental del protegido y ayudante de Davy, el gran científico Michel Faraday (1791-1867) que llevo a cabo (en los primeros años del siglo XIX) sobre la conducción de la electricidad en líquidos. Por otra parte, Faraday acuñó los términos electrolisis, para indicar el proceso de ruptura (del griego lisis, romper) de las moléculas por la electricidad. Electrolito a los compuestos o soluciones capaces de transportar una corriente eléctrica. A las placas o varillas del metal introducidas en la sustancia fundida o solución (generalmente acuosas) de ciertos compuestos principalmente inorgánicos recibieron el nombre de electrodos; al el electrodo que llevaba una carga positiva le llamó ánodo, el que llevaba una carga negativa era el cátodo. Algunos de estos términos le fueron sugeridos por su amigo William Whewell (1794–1866).Su propuesta de la ley de la electrólisis, fue de gran importancia para entender la naturaleza de las fuerzas eléctrica, y los constituyentes eléctricos del átomo.
En sus experimentos Faraday hacia pasar una corriente eléctrica a través de soluciones líquidas ligeramente conductoras y observaba la subsecuente liberación de los componentes de la solución en los electrodos de su cubeta de electrólisis. "En 1833, Faraday descubrió que el pasaje de una cantidad de electricidad dada a través de una solución que contiene un compuesto de hidrógeno, por ejemplo, produce siempre la aparición, en el electrodo negativo (cátodo), de igual cantidad de gas de hidrógeno, independientemente de cual sea el compuesto de hidrógeno que haya sido disuelto e independientemente también de la concentración de la solución, y que además la cantidad de electricidad necesaria para producir un gramo de hidrógeno deposita siempre, en una solución que contiene plata exactamente 107.5 g de plata. Esto significa que dado que el peso del átomo de plata es exactamente 107.5 veces el peso del átomo de hidrógeno, el peso de hidrógeno y el átomo de plata se encuentran asociados en las soluciones exactamente a la misma cantidad de electricidad. Faraday descubrió así que de ese modo todos los átomos que son monovalentes en Química, es to es, que se combina con un átomo de hidrógeno (e.g. cloruro de hidrógeno) llevan precisamente la misma cantidad de electricidad , y que todo los átomos Bivalente se llevan el doble de esta cantidad, y que en general, la valencia, en Química es siempre exactamente proporcional a la cantidad de electricidad llevada por el átomo en cuestión" (b).
Faraday, imaginó que esta carga estaba llevada por el átomo o en algunos casos, por grupos de átomos, y llamó al grupo con su carga un ion, esto es “un viajero” (en griego ion significa viajero). Los iones que viajaban al ánodo eran aniones, los que viajaban al cátodo cationes. A través de la solución pasa carga en forma de iones que poseen defecto o exceso de uno (iones monovalentes) o más electrones (inoes bivalente, trivalentes, etc...). Bajo la influencia de la batería estos iones se mueven hacia el ánodo o hacia el cátodo donde respectivamente ganan o pierden electrones y son liberados como átomos neutros.
Mediante medidas cuantitativas precisas, Faraday descubrió que una misma cantidad de electricidad, F (1 faraday, llamado así en su honor) igual a aproximadamente 96.500 Culombios (C) depositaban siempre en el electrodo una masa (en gramos) exactamente igual a un mol de un ion monovalente. Por ejemplo al pasar 1F a través de una disolución acuosa de sal común, cloruro de sodio (NaCl) , se observa que 23 g de Na (la masa molar del sodio) aparecen en el cátodo y 35.5 g de cloro en el ánodo (la masa molar del cloro), es decir se depositan un mol de cada elemento, porque ambos son monovalentes. Por otra parte Faraday pudo comprobar que la masa de un elemento liberado en un electrodo es directamente proporcional a la carga, así al duplicar la carga se duplica la masa del elemento depositado, y que para la misma cantidad de electricidad la masa de los diferentes productos formados son proporcionales a los respectivos equivalentes químicos, con un equivalente siendo igual a la razón de la masa molecular 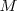 a la valencia (V) del átomo o ion que participa en la reacción).
De forma matemática:
a la valencia (V) del átomo o ion que participa en la reacción).
De forma matemática:
)
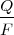
![[1] [1]](/images/math/math-7edb124f6e6e3c0bd88bf6282a8e603a.png)
donde
m, es la masa de la sustancia depositada en un electrodo
Q , es la carga eléctrica total que pasa a través de la sustancia
F , es la constante de Faraday = 96.485,3383(83) C mol-1
M , es la masa molar de la sustancia
V , es el número de valencia de los iones de la sustancia (o electrones transferidos por ion)
Esto es, por ejemplo para iones de valencia 2 (bivalentes), tales como el 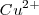 or </math>{(SO_4)^{-2}</math> se requieren 2 faradys para descomponer un mol de sulfato de cobre (
or </math>{(SO_4)^{-2}</math> se requieren 2 faradys para descomponer un mol de sulfato de cobre (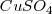 , depositándose por lo tanto ½ mol de los elementos por faraday.
, depositándose por lo tanto ½ mol de los elementos por faraday.
Dado que la masa de un mol se define como el conjunto de átomos cuya masa total en gramos, es numéricamente igual a la masa atómica de dicho elemento, es precisamente igual al número de Avogadro 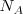 , por lo que es razonable asumir que cada ion monovalente contiene contiene la misma carga e. Lo que permite otra forma de expresar la ley de de la electrólisis de Faraday:
, por lo que es razonable asumir que cada ion monovalente contiene contiene la misma carga e. Lo que permite otra forma de expresar la ley de de la electrólisis de Faraday:
donde
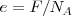
Expresada de este modo la ley de faraday dice que una carga eléctrica F es transportada al electrodo en una cubeta electrolítica cuando un mol de un ion cargado monavalentemente con masa  y carga elementaria
y carga elementaria  ha sido depositado en el electrodo. Por lo tanto pesando el electrodo después de que una carga F se haya transferido producirá
ha sido depositado en el electrodo. Por lo tanto pesando el electrodo después de que una carga F se haya transferido producirá 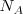 . Así el cociente entre la cantidad de carga de un faraday (F) y el número de Avogadro nos daría la cantidad de electricidad transportada por cada átomo o radical monovalente.Ya que el faraday
. Así el cociente entre la cantidad de carga de un faraday (F) y el número de Avogadro nos daría la cantidad de electricidad transportada por cada átomo o radical monovalente.Ya que el faraday 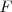 se podía medir con bastante precisión,
se podía medir con bastante precisión, 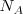 o
o  podía ser determinado si el otro era conocido. Faraday era consciente de ello pero no pudo determinar ninguna de esas dos cantidades. No obstante, esta ley electrolítica ofrecía una prueba bastante concluyente de la existencia de las moléculas químicas propuestas por Avogadro y que estas constan de átomos. Demostraba además que la carga está cuantizada porque a los electrodos solo se transfieren números enteros de carga. Apuntaba también la posibilidad de que los átomos estaban formados por elementos constituyentes cargados positivamente y negativamente, aunque en ese momento la entidad de los mismos permanecía desconocida. Parecía así que la carga eléctrica al igual que la idea atómica de la constitución de la materia parecia no ser continua sino constituida de partículas portadoras de una cantidad discreta de carga eléctrica.
podía ser determinado si el otro era conocido. Faraday era consciente de ello pero no pudo determinar ninguna de esas dos cantidades. No obstante, esta ley electrolítica ofrecía una prueba bastante concluyente de la existencia de las moléculas químicas propuestas por Avogadro y que estas constan de átomos. Demostraba además que la carga está cuantizada porque a los electrodos solo se transfieren números enteros de carga. Apuntaba también la posibilidad de que los átomos estaban formados por elementos constituyentes cargados positivamente y negativamente, aunque en ese momento la entidad de los mismos permanecía desconocida. Parecía así que la carga eléctrica al igual que la idea atómica de la constitución de la materia parecia no ser continua sino constituida de partículas portadoras de una cantidad discreta de carga eléctrica.
Considerando las experiencias de Faraday ,el científico irlandés George Johnstone Stoney (1826-1911) sugirió en una comunicación publicada en 1891 el nombre de electrón (abreviadamente  ) para la “unidad natural de la electricidad” o sea la mínima cantidad de electricidad (o cantidad de carga), que debe pasar a través de una solución para poner en libertad, en uno de sus electrodos, un átomo de hidrógeno o un átomo de cualquier sustancia simple formada por un elemento monovalente. En esa comunicación decía Johnstone ...”por lo tanto pueden existir varias de estas cargas en un átomo químico, y al parecer, hay por lo menos dos en cada átomo. Estas cargas, que serán conviene llamar “electrones”, no pueden ser sacadas del átomo, sino que se disimulan cuando los átomos se unen químicamente...” (b) . Además usando una estima obtenida para
) para la “unidad natural de la electricidad” o sea la mínima cantidad de electricidad (o cantidad de carga), que debe pasar a través de una solución para poner en libertad, en uno de sus electrodos, un átomo de hidrógeno o un átomo de cualquier sustancia simple formada por un elemento monovalente. En esa comunicación decía Johnstone ...”por lo tanto pueden existir varias de estas cargas en un átomo químico, y al parecer, hay por lo menos dos en cada átomo. Estas cargas, que serán conviene llamar “electrones”, no pueden ser sacadas del átomo, sino que se disimulan cuando los átomos se unen químicamente...” (b) . Además usando una estima obtenida para 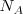 a partir de la teoría cinética de los gases G.J. Stoney pudo computar utilizando la ecuación el valor de e de aproximadamente
a partir de la teoría cinética de los gases G.J. Stoney pudo computar utilizando la ecuación el valor de e de aproximadamente 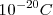 . Después de que J. J. Thomson descubriera la partícula (“corpúsculos” en la terminología original de Thomson) que lleva o porta la unidad fundamental de carga, el nombre de electrón fue transferido por el gran físico holandés Hendrik A. Lorentz (1853-1928) desde la cantidad de carga para desiganar con el nombre de electrones a los corpúsculos de Thomson.
. Después de que J. J. Thomson descubriera la partícula (“corpúsculos” en la terminología original de Thomson) que lleva o porta la unidad fundamental de carga, el nombre de electrón fue transferido por el gran físico holandés Hendrik A. Lorentz (1853-1928) desde la cantidad de carga para desiganar con el nombre de electrones a los corpúsculos de Thomson.
Tubos de descargas: rayos catódicos y canales
Hacia finales del siglo XIX, los físicos centraron su atención a el paso de la electricidad por los gases, se sabia desde hacia mucho tiempo que los gases de ordinario son unos aislantes eléctricos bastantes buenos, aunque pueden ser atravesadas a veces por tensiones eléctricas elevadas (como ocurre en los rayos que son producidos en las tormentas eléctricas). El físico inglés Sir Willian Crookes (1832 -1919) descubrió que el paso de la corriente eléctrica a través de un gas encerrado en un tubo de cristal de tipo Geissler (tubos experimentales construidos en el siglo XIX por el físico y soplador de vidrio J.H.W. Geissler, 1814 - 1879, predecesores de los modernos tubos fluorescentes) se producía más fácilmente a través de un gas si se reducía la presión de este dentro del tubo a una pequeña fracción de una atmósfera. El perfeccionamiento de las bombas de vacío por difusión de mercurio, permitía obtener vacíos por debajo de 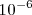 atmósferas (atm) fue un aspecto clave en el estudio de la descarga eléctrica en estos tubos.
atmósferas (atm) fue un aspecto clave en el estudio de la descarga eléctrica en estos tubos.
Por ejemplo, se puede observar que si entre los electrodos de un tubo de Crookes se aplica una diferencia de potencial de 10000 voltios (V) ninguna descarga eléctrica ocurre hasta que parte del gas es evacuado (bombeado) fuera del tubo. La naturaleza de la descarga la cual esta asociada con la emisión de luz por el gas en el tubo cambia a medida que la presión desciende. Así, se observa que la descarga eléctrica comienza a ocurrir cuando la presión del gas del interior del tubo desciende por debajo de 0.01 atmóferas. A esta presión el transporte de electricidad tiene lugar a través del gas mostrado por el flujo de una corriente eléctrica entre los electrodos del circuito exterior, y el gas aparece entonces luminoso. Si se sigue evacuando gas del tubo, y la presión es menor de 0.001 atm un espacio oscuro (llamado espacio oscuro de Crookes) aparece en las cercanías del cátodo y unas estriaciones brillantes son observadas a lo largo del resto del tubo. A presiones aún más bajas 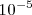 atmosferas (atm) el tamaño del espacio oscuro se incrementa , y a una presión de
atmosferas (atm) el tamaño del espacio oscuro se incrementa , y a una presión de 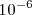 a
a 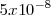 atm ocupa todo el conjunto del tubo. A esta baja presión ninguna luz es emitida por el gas residual contenido todavía en el tubo, la luminiscencia pues del gas desaparece, pero aparece entonces perfectamente definido un haz que va del cátodo al ánodo y que choca contra el cristal de las paredes del extremo del tubo de descarga, el cual entonces resplandece (fluoresce) con una luz difusa ligeramente amarillenta-verdosa
atm ocupa todo el conjunto del tubo. A esta baja presión ninguna luz es emitida por el gas residual contenido todavía en el tubo, la luminiscencia pues del gas desaparece, pero aparece entonces perfectamente definido un haz que va del cátodo al ánodo y que choca contra el cristal de las paredes del extremo del tubo de descarga, el cual entonces resplandece (fluoresce) con una luz difusa ligeramente amarillenta-verdosa
El físico y matemático alemán Julius Plücker usando un tubo de Geissler-Crookes fue el primero que observo rayos catódicos en 1859. En 1876 el físico alemán Goldstein consiguió probar que los rayos provenían del cátodo, y los nombró por ellos rayos catódicos (en alemán lkathodenstrahlen), para significar el hecho de que emanaban del cátodo del tubo de descarga, y el tubo donde se producía recibió el nombre de tubos de rayos catódicos. El físico alemán Johann Wilhelm Hittorf (1834-1914), observó en 1869 que los rayos de que emanaban a partir del cátodo seguían lineas rectas lo cual pudo ser probado por la sombra bien definida que se producida en una pantalla fluorescente cuando un obstáculo fue interpuesto en la vía de los rayos catódicos. El físico francés Jean. B. Perrin (1870-1942) en 1895, fue capaz de demostrar que los rayos eran deviados por un campo magnético y introdujo en el tubo de descarga un cubierta con una ranura, de tal manera que le permitió formar un fino haz de rayos catódicos, situó además una pantalla fluorecescente en el tubo para seguir la trayectoria del haz por la traza dejada de fluorescencia. Cuando situó un imán cerca del tubo de tal manera que las lineas de fuerza del campo magnético fueran perpendiculares a la dirección del movimiento de los rayos catódicos el haz fue observado que se desviaba. A partir del hecho de que los rayos catódicos podían ser desviados por campos magnéticos, Perrin concluyo correctamente que los mismos debían de ser partículas cargadas y a partir de la dirección de desviación concluyo que eran partículas cargadas negativamente. Además, Perrin confirmó adicionalmente este hecho al observar que los rayos catódicos depositaban carga negativa en un aparato denominado electrómetro. Perrin obtuvo el premio Nobel en 1905 por sus trabajos en rayos catódicos.
Hasta ese momento, todo parecía indicar que estas partículas deben estar cargadas negativamente al pasar a través del gas enrarecido, de la misma manera que Faraday imaginaba que los iones se mueven a través de los líquidos en el proceso de electrólisis. La diferencia esencial era desde luego, que mientras en el caso de la electrólisis los iones tienen que abrirse su camino lentamente a través de las moléculas estrechamente apretadas del líquido y nunca pierden su rumbo opuesto, los rayos catódicos en los gases enrarecidos siguen la línea recta y chocan con cualquier cosa interpuesta en su trayectoria. Además, se pudo demostrar que los constituyentes de esos rayos deberían tener masa pues eran capaces de mover las paletas de un pequeño molinillo puesto en su camino. Así, al final del siglo XIX había físicos que defendían la naturaleza corpuscular de los rayos catódicos, es decir que los mismos se encontraban constituidos de partículas con carga negativa, no obstante otros científicos destacados de la época como Philipp Lenard (1862-1947) no estaba de acuerdo esa interpretación particular para la naturaleza de los rayos catódicos, pues pensaban que los mismo podía ser algún tipo de radiación electromagnética o de algún tipo de vibración del éter del por aquel entonces hipotético medio en el que se suponían vibraran las ondas electromagnéticas.
Los experimentos cuantitiativos precisos de la relación carga-masa 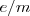 de los rayos catódicos proporcionaron al científico inglés J.J. Thomson la la primera evidencia experimental clara de que los rayos catódicos consisten de partículas muchos más ligeros que los átomos, y obtuvo por ello todo el crédito del descubrimiento de los electrones.
de los rayos catódicos proporcionaron al científico inglés J.J. Thomson la la primera evidencia experimental clara de que los rayos catódicos consisten de partículas muchos más ligeros que los átomos, y obtuvo por ello todo el crédito del descubrimiento de los electrones.
Modelo atómico de Thomson
El científico inglés Sir Joseph John Thomson (1856-1940), conocido como “(J.J)” Thomson a finales del siglo XIX (entonces director del famoso laboratorio Cavendish de la Universidad de Cambridge), determinó de una manera directa la relación 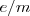 de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos.
de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos.
El instrumento que J.J Thomson empleó para determinar la relación carga-masa (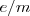 ) de los rayos catódicos es el precursor de los actuales tubos de televisión, del osciloscopio, de las pantallas de radar, etc.... El aparato consistía en un tubo de descarga de vidrio en el que se había hecho un vacío elevado, disponiendo en su interior de varios electrodos metálicos (cátodo, ánodo), dos ánodos de colimación (A1 y A2) que permiten generar un fino haz de rayos catódicos, los cuales son acelerados por la aplicación de un alto voltaje entre cátodo y el ánodo, pasando los mismos entre dos placas paralelas construidas en el tubo. La aplicación de un voltaje a esas placas produce un campo eléctrico (
) de los rayos catódicos es el precursor de los actuales tubos de televisión, del osciloscopio, de las pantallas de radar, etc.... El aparato consistía en un tubo de descarga de vidrio en el que se había hecho un vacío elevado, disponiendo en su interior de varios electrodos metálicos (cátodo, ánodo), dos ánodos de colimación (A1 y A2) que permiten generar un fino haz de rayos catódicos, los cuales son acelerados por la aplicación de un alto voltaje entre cátodo y el ánodo, pasando los mismos entre dos placas paralelas construidas en el tubo. La aplicación de un voltaje a esas placas produce un campo eléctrico (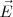 ) y con un imán se produce un campo magnético (
) y con un imán se produce un campo magnético (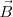 ) en dirección perpendicular al campo eléctrico; como veremos posteriormente este ordenamiento actúa como un selector de velocidad. Situada en el extremo opuesto del tubo se situaba una pantalla fluorescente de sulfuro de zinc, para detectar el punto de incidencia del haz de rayos catódicos, pudiendo medir con ello la desviación de su trayectoria rectilínea.
) en dirección perpendicular al campo eléctrico; como veremos posteriormente este ordenamiento actúa como un selector de velocidad. Situada en el extremo opuesto del tubo se situaba una pantalla fluorescente de sulfuro de zinc, para detectar el punto de incidencia del haz de rayos catódicos, pudiendo medir con ello la desviación de su trayectoria rectilínea.
Veamos como utilizando este aparato J.J. Thomson determinó experimental mente la relación carga-masa del electrón
Consideraciones teóricas previas
Cuando se aplica simultáneamente de manera perpendicular (i.e. con un águlo de 90º) un campo magnético 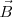 y un campo eléctrico
y un campo eléctrico 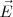 uniformes a una partícula cargada
uniformes a una partícula cargada  en movimiento con una velocidad
en movimiento con una velocidad  la fuerza total (llamada fuerza de Lorentz) que experimenta la carga
la fuerza total (llamada fuerza de Lorentz) que experimenta la carga 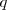 esta dada por ley de Lorentz, en forma vectorial:
esta dada por ley de Lorentz, en forma vectorial:
![(\vec F=q[\vec E+ (\vec v x \vec B)] (\vec F=q[\vec E+ (\vec v x \vec B)]](/images/math/math-7ca27fd2d8da11b039bf55fafcd1324c.png)
![[1] [1]](/images/math/math-a5e3f5e17b927757c8bfa5f817bc504e.png) [[1]]
[[1]]
con una componente de fuerza eléctrica y otra magnética.
La dirección de la fuerza magnética 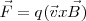 es perpendicular tanto a la dirección del campo magnético (
es perpendicular tanto a la dirección del campo magnético (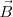 ) y a la velocidad (
) y a la velocidad (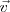 ), estando dada la magnitud de esta fuerza magnética por
), estando dada la magnitud de esta fuerza magnética por 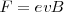 y bajo la acción de esta fuerza las partículas cargadas se mueven en una trayectoria circular de radio
y bajo la acción de esta fuerza las partículas cargadas se mueven en una trayectoria circular de radio  , dirigida perpendicularmente al campo (
, dirigida perpendicularmente al campo (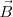 ), en una dirección completamente contraria y opuesta (i.e. hacia abajo) a la dirección (i.e hacia arriba, cuando la placa superior que produce el campo eléctrico es positiva) imprimida a la partícula cargada por la fuerza eléctrica
), en una dirección completamente contraria y opuesta (i.e. hacia abajo) a la dirección (i.e hacia arriba, cuando la placa superior que produce el campo eléctrico es positiva) imprimida a la partícula cargada por la fuerza eléctrica 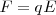 , lo esperable para una partícula cargada negativamente
, lo esperable para una partícula cargada negativamente  .
.
El radio  puede ser obtenido a partir de la segunda ley del movimiento de Newton
puede ser obtenido a partir de la segunda ley del movimiento de Newton
(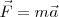 ) igualando la fuerza magnética
) igualando la fuerza magnética 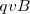 a m veces la aceleración centrípeta
a m veces la aceleración centrípeta 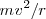 . La fuerza de magnética
. La fuerza de magnética 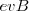 está dirigida hacia el centro del círculo.
está dirigida hacia el centro del círculo.
A partir de estas ecuaciones el radio  se puede calcular.
se puede calcular.
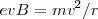 </math>{2}</math>
</math>{2}</math>
y así tenemos:
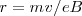
![[3] [3]](/images/math/math-5997f14afe377dff877df1d1629d9c02.png)
donde:
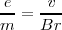
![[4] [4]](/images/math/math-b89757a59b41b6506218bd6647cd5ee7.png)
Donde  el radio de la curvatura y el valor
el radio de la curvatura y el valor 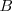 pueden ser medios y
pueden ser medios y  es una cantidad desconocida que hay que calcular.
es una cantidad desconocida que hay que calcular.
Determinación de la relación 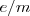
Por otra parte si se escogen las intensidades adecuadas de los dos campos (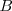 y
y 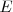 ), de forma que la relación de la magnitud de la fuerza eléctrica y magnética sean iguales tenemos que:
), de forma que la relación de la magnitud de la fuerza eléctrica y magnética sean iguales tenemos que:
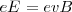
![[2] [2]](/images/math/math-ec736101c15bd1d1133c7e3d7015ddd9.png)
De la expresión encontramos que
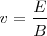
![[5] [5]](/images/math/math-311713d7e899562efc3b7c08c8a01ccb.png)
De esta manera se podía también encontrar la velocidad de las partículas, introduciendo el valor de intensidad del campo E y B, la cual solo dependerá del Voltaje (V) aplicado entre el cátodo y el ánodo según la relación (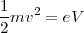 ); por lo que
); por lo que ![v=[2V(e/m)]^{1/2} v=[2V(e/m)]^{1/2}](/images/math/math-441e70dd873e91e7afa372ee0933a152.png)
![[6] [6]](/images/math/math-efa651c624c49f90c998fb329daf1ea9.png)
Cuando se cumple la relación la partícula con carga 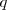 se mueve entonces en linea horizontal rectilínea a través de la región de los campos
se mueve entonces en linea horizontal rectilínea a través de la región de los campos 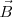 y
y 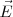 , por lo que inciden sobre la pantalla fluorescente situada al final del tubo, en el mismo punto que si no hubiera ningún campo eléctrico o magnético. De esta manera, solo las partículas que tengan una velocidad
, por lo que inciden sobre la pantalla fluorescente situada al final del tubo, en el mismo punto que si no hubiera ningún campo eléctrico o magnético. De esta manera, solo las partículas que tengan una velocidad  adecuada pasarán sin desviarse a través de los campos eléctricos y magnéticos orientados perpendicularmente. Si la fuerza magnética que se ejerce sobre las partículas que se mueven a velocidades más elevadas es mayor a la fuerza eléctrica, lo que desvía las partículas hacia arriba. Las que se mueven a velocidades menores se desvían hacia abajo. Por ello se dice que este ordenamiento de los campos
adecuada pasarán sin desviarse a través de los campos eléctricos y magnéticos orientados perpendicularmente. Si la fuerza magnética que se ejerce sobre las partículas que se mueven a velocidades más elevadas es mayor a la fuerza eléctrica, lo que desvía las partículas hacia arriba. Las que se mueven a velocidades menores se desvían hacia abajo. Por ello se dice que este ordenamiento de los campos 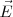 y
y 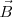 es un selector de velocidad , pues permite que las partículas cargadas se muevan a la misma velocidad durante la realización del experimento (un aspecto clave del mismo). Los valores de
es un selector de velocidad , pues permite que las partículas cargadas se muevan a la misma velocidad durante la realización del experimento (un aspecto clave del mismo). Los valores de  con los que Thompon operó en sus experimento de 1897, fueron del orden de
con los que Thompon operó en sus experimento de 1897, fueron del orden de 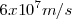 ; unas velocidades los suficientemente bajas como para no considerar los efectos relativistas, en aquel tiempo desconocidos.
; unas velocidades los suficientemente bajas como para no considerar los efectos relativistas, en aquel tiempo desconocidos.
Conociendo la velocidad de los rayos catódicos se podía determinar así la relación 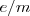 midiendo el desvío del haz producido cuando el campo magnético o el campo eléctrico actúa solo.
La relación
midiendo el desvío del haz producido cuando el campo magnético o el campo eléctrico actúa solo.
La relación 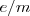 se puede calcular combinando la expresión a partir de la expresión:
se puede calcular combinando la expresión a partir de la expresión:
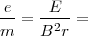
![[7] [7]](/images/math/math-c7e87f6a9b372fed3cdc993d50c13979.png)
Ecuación que nos puede dar una medida directa de la relación 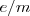 , ajustar el Voltímetro y el Amperimetro del aparato y introduciendo los valores de las medida de
, ajustar el Voltímetro y el Amperimetro del aparato y introduciendo los valores de las medida de  . El valor original obtenido para la relación
. El valor original obtenido para la relación 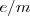 fue de aproximadamente
fue de aproximadamente 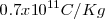 . Un poco por debajo del valor actual obtenido para
. Un poco por debajo del valor actual obtenido para 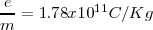 (en parte porque no había considerado el el campo magnético exterior de las región de las placas deflectoras). Thomson repitió el experimento de determinación
(en parte porque no había considerado el el campo magnético exterior de las región de las placas deflectoras). Thomson repitió el experimento de determinación 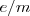 con diferentes gases en el tubo (aire, hidrógeno, dióxido de carbono, etc... ), y diferentes metales (cobre, hierro, plomo, plata, estaño o cinc) en el cátodo y siempre obtuvo el mismo valor de
con diferentes gases en el tubo (aire, hidrógeno, dióxido de carbono, etc... ), y diferentes metales (cobre, hierro, plomo, plata, estaño o cinc) en el cátodo y siempre obtuvo el mismo valor de 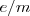 dentro de los valores de error experimental. Mostrando así que las partículas eran comunes a todos los metales.
dentro de los valores de error experimental. Mostrando así que las partículas eran comunes a todos los metales.
George Johnstone Stoney había acuñado el vocablo electrón en 1891 para designar la cantidad de electricidad que es capaz de depositar un gramo de hidrógeno en la electrolisis del agua. Según la ley de la electrólisis de Faraday, esa cantidad es aproximadamente 95.500 C/g, para explicar esta ley Stoney, supuso también la existencia de una carga elemental  de electricidad, que estaría asociada con cada átomo de hidrógeno. Bajo esta hipótesis entonces la ratio entre la carga e y la masa del átomo de hidrógeno
de electricidad, que estaría asociada con cada átomo de hidrógeno. Bajo esta hipótesis entonces la ratio entre la carga e y la masa del átomo de hidrógeno 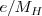 era de 95.500 C/g. Si la misma carga eléctrica está involucrada en ambos casos (en los rayos catódicos y en el fenómeno de la electrólisis), entonces la masa de de las partículas presentes en los rayos catódicos deben ser aproximadamente 1000 veces más pequeña que la masa del átomo de hidrógeno. Aunque ese valor fue posteriormente revisado y hoy conocemos la masa de las partículas de los rayos catódicos (el electrón) es (relación
era de 95.500 C/g. Si la misma carga eléctrica está involucrada en ambos casos (en los rayos catódicos y en el fenómeno de la electrólisis), entonces la masa de de las partículas presentes en los rayos catódicos deben ser aproximadamente 1000 veces más pequeña que la masa del átomo de hidrógeno. Aunque ese valor fue posteriormente revisado y hoy conocemos la masa de las partículas de los rayos catódicos (el electrón) es (relación 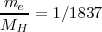 ) veces la del átomo del hidrógeno.
) veces la del átomo del hidrógeno.
En base a estos resultados experimentales, Thomson fue llevado a una conclusión inevitable,
En palabras de Thomson esta propuesta que en su tiempo fue audaz se puede leer en inglés como:
"I can see no escape from the conclusion that [cathode rays] are charges of negative electricity carried by particles of matter."
No puedo escapara la conclusión de que [los rayos catódicos] son cargas de electricidad negativa llevadas por partículas de materia
"What are these particles? are they atoms, or molecules, or matter in a still finer state of subdivision?"
Qué son estas partículas? Son átomos, o moléculas o materia en un estado más fino de subdivisión?.
"We have in the cathode rays matter in a new state, a state in which the subdivision of matter is carried very much further than in the ordinary gaseous state: a state in which all matter... is of one and the same kind; this matter being the substance from which all the chemical elements are built up."
Tenemos en los rayos catódicos materia en un nuevo estado, un estado en el cual la subdivisión de la materia es llevada más allá que la del estado ordinario gaseoso: un estado en el cual toda la materia...es de uno y una misma clase; esta materia es la sustancia a partir de la cual todos los elementos están construidos.
Las partículas recibieron el nombre de electrones de la mano del gran físico holandés Hendrik A. Lorentz que transfirió así este nombre el nombre propuesto por G.H. Stoney para una cantidad de electricidad fundamental a las partículas constituyentes de los rayos catódicos.
Los electrones constituían así la primera partícula subatómica fundamental en ser descubierta.
El átomo químico indivisible de Dalton empezaba a ser sustituido por un átomo físico que posee una estructura interna. La medida directa de la relación 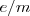 de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos.
de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos.
El siguiente hito en el estudio del electrón fue la determinación cuantitativa de la masa (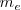 ) y la carga eléctrica
) y la carga eléctrica  portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano Robert. A. Millikan (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga
portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano Robert. A. Millikan (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga  .
.
Modelo de atómico de Thomson
Tubos de rayos catódicos, una página web dedicada a con la historia de estos aparatos: [[2]]
Artículo G.H. Stoney sobre el electrón: [[3]]
Artículo original de Thopmson: [[4]] Con el diagrama original de Thomson de su tubo de rayos catódicos:
Página dedicada al centenary del descubrimiento del electrón po J.J. Thomson [[5]]
Se pueden escuchar en las propias palabras (en inglés) su descubrimiento del electrón: [[6]]
Could anything at first sigth seem more impractical than a body which is so small that its mass is an insignificant fraction of the mass os an atom of hydrogen?
Podría algo a primera vista parecer tan impráctico como que un cuerpo sea así de pequeño que su masa es una fracción insignificante de la masa de un átomo de hidrógeno?
Biliografía
* George Gamov. Biografía de la Física. Alianza Editorial.1980
Libros clásicos:
* Roberto Andrés Millikan. Electrones, protones, fotones, neutrones y Rayos cósmicos. Espasa-Calpe Argentina S.A, 1946. Un libro clásico escrito por unos de los científicos que determinó por primera vez con su famoso experimento de la gota de aceite una relación carga-masa (e/m) precisa para el electrón.
Enlaces externos
Una animación del funcionamiento de un tubo de Crookes: [[7]]
Tubos de rayos catódicos, una página web dedicada a su historia:
[[8]]
Tweet