Aspecto dinámico de las condiciones del equilibrio. Igualdad de las velocidades de reacción directa e inversa
De Wikillerato
Chemaseg (Discutir | contribuciones)
(Página nueva: El equilibrio químico es un ''estado dinámico'', en el cual según la cinética química, las velocidades de reacción directa e inversa se igualan. Para una reacción rev...)
Ir a las siguientes diferencias →
Revisión de 09:49 1 jul 2010
El equilibrio químico es un estado dinámico, en el cual según la cinética química, las velocidades de reacción directa e inversa se igualan.
Para una reacción reversible del tipo:

La cual ocurre en una sola fase homogénea y en una sola etapa (tanto para la reacción directa como la inversa), entonces tenemos que para la velocidad del proceso directo 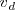
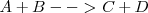 es:
es:
Y la velocidad de la reacción inversa 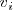
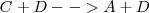 es :
es :
Supongamos que un recipiente se introduce una cierta cantidad de los reactivos A y B, al comienzo la reacción directa será rápida, mientras que la inversa, al no haber ni C ni D, no se producirá. A medida que transcurre la reacción directa aumentan la concentración de C y D. Por lo tanto ahora la reacción directa se ralentiza y al contrario la inversa se acelera. Esto ocurrirá hasta que las dos velocidades se igualen, momento a partir del cual la concentración de las cuatro substancias reaccionates permanecerán estables; se alcanzado entonces el equilibrio dinámico de la reacción. En el mismo no son nulas las velocidades para el proceso directo e inverso lo que ocurre es que se igualan.
En el momento que se haya alcanzado el equilibrio dinámico, las velocidades directas e inversas se igualan, esto es:
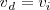 lo que implica por tanto que:
lo que implica por tanto que:
![k_d [A] [B] = k_i [C] [D] k_d [A] [B] = k_i [C] [D]](/images/math/math-eaa5f8413c92578ade8244f4120580d1.png)
Y agrupando los términos constantes, obtenemos la expresión
Que se mantiene constate con un valor 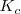 en el equilibrio. Es decir, una vez alcanzado el equilibrio, las concentraciones mantienen una proporción, de forma que el cociente anterior se mantiene constante. Ese valor se denomina constante de equilibrio y se designa por
en el equilibrio. Es decir, una vez alcanzado el equilibrio, las concentraciones mantienen una proporción, de forma que el cociente anterior se mantiene constante. Ese valor se denomina constante de equilibrio y se designa por 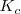 cuando se expresa en función de las concentraciones
cuando se expresa en función de las concentraciones  . El valor de constante depende de la temperatura, ya que las constantes de velocidad (
. El valor de constante depende de la temperatura, ya que las constantes de velocidad (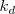 y
y 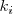 dependen de ella. La constante de equilibrio de una reacción determinada depende únicamente de la temperatura, cuando varia la temperatura cambia el valor numérico de la constante de equilibrio y por tanto se establece un equilibrio distinto del anterior.
dependen de ella. La constante de equilibrio de una reacción determinada depende únicamente de la temperatura, cuando varia la temperatura cambia el valor numérico de la constante de equilibrio y por tanto se establece un equilibrio distinto del anterior.


![v_d=k_d [A] [B] v_d=k_d [A] [B]](/images/math/math-d7243c0b9a3d5f16dd5fce3d11e73595.png)
![v_i= k_i [C] [D] v_i= k_i [C] [D]](/images/math/math-96a529ecff4ef654e2816b1acac961ca.png)
![\frac {{k_d}} {{k_i}} = \frac{ [C]^{c} [D]^{d}}{[A]^{a} [B]^{b}}= K_c \frac {{k_d}} {{k_i}} = \frac{ [C]^{c} [D]^{d}}{[A]^{a} [B]^{b}}= K_c](/images/math/math-4a5c612ee59bb4752a8b97462d836a4b.png)

