Teoría atómica, la naturaleza discreta de la materia
De Wikillerato
Atomismo filosófico
El hombre siempre ha estado en contacto con el cambio especialmente aquellos que son útiles o dramáticos (su propio nacimiento, desarrollo y muerte es una prueba de ello). Seguramente la quema de madera de un árbol y su conversión en cenizas tuvo que dejar una honda impresión entre aquellos los primeros Homo sapiens antepasados nuestros, que se calentaban entre las primeras hogueras, en las gélidas noches de invierno. El paso de las estaciones con sus diferentes manifestaciones naturales (clima, floraciones, etc...) tuvo que también dejar también una impresión indeleble en la conciencia de aquellos primeros hombres. Con el advenimiento de la forja de metales y aleaciones metálicas para construir distintos elementos defensivos, flechas, espadas, etc... el hombre se percató claramente de la naturaleza moldeable de ciertos metales, otras transformaciones útiles como la que da lugar a la cerveza o al vino tuvieron que ser también muy apreciadas.
Fuera de las explicaciones míticas, fue en la Grecia del siglo VI a.C. donde surgieron las primeras reflexiones y especulaciones filosóficas a la luz del logos (palabra, razón) sobre la naturaleza y realidad de estos cambios. Obsesionados con la diferencia entre apariencia y realidad, los primeros filósofos que indagaron sobre la naturaleza de la Realidad Física Natural (Physis, φυσικός la palabra griega que significa Física o Naturaleza) , así mientras que Parménides (vivió en Elea, colonia griega del sur de Magna Grecia, actual Italia, alrededor de 510- 450 a. C.) negaba la realidad del cambio, siendo este solamente una ilusión, el Ser de la Naturaleza es Uno, es cerrado igual así mismo, a la que nada se le puede añadir, es una Realidad ajena a cualquier cambio y movimiento, siendo la pluralidad de los seres naturales una ilusión sensorial. Parménides es el introductor de la fundamental distición entre la verdad (de razón) y la apariencia. Un ente no puede ser y dejar de ser, "El ser es y el no-ser no es" era una de sus máximas, por lo tanto el Ser, “lo Ente” no surge del ser ni del no-ser, nunca a empezado a ser, sino que simplemente es, de esta manera el devenir es negado, si el ser fuera engendrado del no-ser se incurriría en una contradicción, pues el no ser es la nada y esta no puede dar origen al ser, por lo tanto el cambio el devenir y el movimiento son imposibles, para cambiar el ser debería de dejar de ser para no-ser, de esta manera también se niega la idea de vacío, el Ser no puede tener “huecos” de no-ser.
Por el contrario, Heráclito (hacia 540-475 a. C.) coetáneo de Parménides vivió en Efeso una ciudad vecina de Mileto en las costas de Asia menor, actual Turquía) argumentaba que el cambio es la verdadera realidad de la Naturaleza, nada permanece, todo esta en continuo flujo, todo pasa y nada permanece, “no puede bañarse uno dos veces en el mismo río”, pues las aguas del mismo siempre distintas, la auténtica realidad es el proceso dinámico de cambio: “Todas las cosas están en movimiento nada está fijo”. El fuego en continua mutación, siempre diferente así mismo era para Heráclito, era el elemento que mejor representaba su doctrina de cambio eterno.
Siguiendo las doctrina de Empédocles (hacia 490-430 a. C.) de Agrigento en Silicia (actual Italia), que había tratado de conciliar la negación parmideana del devenir con el hecho evidente observado de cambio, con el postulado de la existencia de cuatro elementos (el aíre, fuego, tierra, agua), que mezclados unos con otros formaban los objetos de nuestra experiencia. Alrededor del año 440 a.C. el Jonio Leucipo de Mileto (ciudad griega situada en Asia menor, actual Turquía y su discípulo Demócrito de Abdera, ciudad al norte del Egeo (hacia 460-371 a. C.) propusieron por primera vez una idea que permitía salvar las apariencias observada en los cambios naturales y mantener al mismo tiempo una realidad duradera ajena al cambio, introdujeron para ello el concepto de átomo. En griego ἄτομον significa indivisible, el prefijo a significa no, y el vocablo atomos significa cortar, así a-tomos significa lo que no puede ser cortado, el átomo sería así el último elemento material que no puede ya ser dividido. Ambos filósofos introdujeron también el concepto de vacío en sus especulaciones filosóficas, un "elemento" también esencial de la doctrina atomista. Diferentes átomos indestructibles e indivisibles componen como últimos elementos las sustancias y objetos naturales, por otra parte el cambio observado en la Naturaleza es el cambio en la posición y de ordenación de esos átomos en el vacío. Los átomos de Demócrito tenían distintas formas y tamaño, pero no tienen cualidad, excepto la de ser sólidos impenetrables. Una realidad atómica subyace al fenómeno de la apariencia del cambio, el cual es tan real como las entidades indivisibles (átomos) que lo permiten, por otra parte los átomos permanecen aeternitas en su ser parmenídeo inmutable, en un incesante movimiento también eterno. Así, según Demócrito, los átomos en número infinito representan la estática de ser de la Naturaleza mientras que sus movimientos o agitación en el vacío y su composición cambiante explicaría la diversidad de la materia y su cambio con el tiempo.
Debido a la influencia de los grandes filósofos Platón (hacia 427-347 a.C) [[1]] y Aristóteles (384-322 a.C.) [[2]]que por diversas razones filosóficas no creían en la doctrina atomista (pensaban que la materia era una entidad continua, la naturaleza no hace saltos, pensamiento expresado en el “horroris vacuum” de Aristóteles), la teoría de Democrito y Leucipo fue abandonada y casi olvidada hasta que filósofo Epicuro (341-271 a.C.) atribuyera a los átomos no solo tamaño y forma sino también peso (masa) para explicar el movimiento de caída de los cuerpos. Después de Epicuro, la teoría atómica fue olvidada duranre muchos siglos. Un seguidor de Epicuro, el poeta y filósofo romano Tito Lucrecio Caro (95-55 a.C.) conocido simplemente como Lucrecio, expuso la teoría de Demócrito y Epicureo en un largo poema titulado en latín De Rerum Natura (“sobre la Naturaleza de las cosas). Muchos lo consideran el mejor poema didáctico jamás escrito.
Debido en parte a la influencia de la iglesia cristiana que no aceptaba la visión materialista de que cada cosa, incluido el ser humano podría ser descompuesto en átomos, debido a que entraba en contradicción con la creencia de un Dios creador de los cuerpos y del alma humana.
Así, aunque Leucipo y Demócrito fueron los primeros en sugerir como especulación filosófica la existencia de los átomos, y por lo tanto que la materia en última instancia es discreta (discontinua) pasaron casi dos milenios antes de que el átomo fuera situado en el centro de los estudios químicos, como un objeto químico fundamental. Ello fue debido a que con la fundación de la Ciencia Moderna en el siglo XVII, la experimentación y la obtención de evidencias experimentales como acción para obtener y cimentar el conocimiento de la Naturaleza fue una condición sine equanum para validar cualquier idea teorética especulativa (acción que los filósofos griegos nunca consideraron). Así basado en los resultados de un experimento científico (aquel que se realiza bajo condiciones controladas), un modelo de investigación es desarrollado (expresado generalmente en lenguaje matemático). Este modelo frecuentemente permite predicciones sobre otros experimentos, estos nuevos experimentos pueden conducir a un refinamiento del modelo o a su modificación. Así en un proceso iterativo de experimentación-modelización teórica un modelo teórico puedes ser refinado y alcanzar un modelo que “refleja la realidad” lo mayor precisión posible. Un proceso de este tipo se observa claramente en el desarrollo de los diferentes modelos atómicos que se han desarrollado a lo largo de la historia científica moderna desde comienzos del siglo XIX hasta nuestros días.
Atomismo químico
El primer avance significativo hacia la moderna teoría atómica de la materia fue realizado por lo químicos en el siglo XVIII. Las transformaciones en la que se observa un cambio aparente de la composición de la materia se denominan transformaciones químicas, y serán el objeto de la nueva ciencia de la Química. Los químicos, los científicos que profesan la ciencia química encontraron que muchas reacciones químicas, en la que habían pesado de manera precisa las masas de los reactivos y de los productos finales de la reacción, podían explicarse mejor por la hipótesis de que los sustancias reactivos consisten de átomos o moléculas que pueden recombinarse para dar lugar a otras moléculas.
Las regularidades empíricas observadas por los químicos fueron resumidas en una serie de “leyes Químicas”:
1.- La ley de la conservación de la masa
En las reacciones químicas ordinarias no existen transformaciones apreciables de masa y energía. Esto quiere decir que los productos de las reacciones químicas tienen en total la misma masa que las sustancias iniciales (reactivos). esto es, en las reacciones químicas la masa ni se crea ni se destruye. Esta ley fue formulada por el considerado “ el fundador y padre de la química moderna”: el químico francés Antoine-Laurent de Lavoiser (1743-1794) como consecuencia de la introducción en el laboratorio de química de un instrumento sencillo la balanza para cuantificar (pesar) de una manera precisa en un recipiente cerrado (aislado del medio exterior para que nada se pierda ni se gane) la masa de la reacción antes y después de los cambios químicos tuvieran lugar.
Lavoiser dio nombre a elementos tan importantes como el Oxigeno y al Nitrógeno, y con sus concienzudos y precisos trabajos experimentales Lavoisier desacreditó la vieja “teoría del flogisto” (flogisto, el principio de la inflamabilidad, una palabra griega que significa “hacer arder”) propuesta por el químico y físico Georg Ernest Stahl (1660-1734) para explicar la combustión, la quema de sustancias combustibles (e.g. madera) que al arder producen llama, siendo el primero en entender que la combustión es un proceso de combinación (reacción) del combustible (sustancia oxidable) con el oxígeno (oxidación) que va acompañada del desprendimiento de energía en forma de calor que se manifiesta como una llama o incandescencia.
Desde su proposición por Lavoiser en el siglo XVIII, experimentos de cuantificación de la masa otros químicos ayudaran a confirmar esta ley, así por ejemplo el químico alemán Landolt realizó en los años finales del siglo XIX algunos de los experimentos más cuidadosos y precisos para la época ideados para determinar si se conserva o no la masa en las transformaciones químicas. Ente las muchas reacciones que estudió, una de ellas la que se produce entre el sulfato de plata 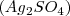 y el sulfato ferroso
y el sulfato ferroso 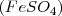 para dar plata libre
para dar plata libre 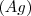 y sulfato férrico
y sulfato férrico ![[Fe_2(SO_4)_3] [Fe_2(SO_4)_3]](/images/math/math-6f22f2339e9896dbd8c9609b6397ad8d.png) . Encerró separadamente las soluciones de sustancias reaccionantes en los dos brazos de un recipiente tubular en forma de V invertida. Pesó la vasija antes de la reacción y la invirtió en seguida para que esta se produjese, volviéndola a pesar después luego de terminada. El cambio de masa observado por él fue de una pérdida
. Encerró separadamente las soluciones de sustancias reaccionantes en los dos brazos de un recipiente tubular en forma de V invertida. Pesó la vasija antes de la reacción y la invirtió en seguida para que esta se produjese, volviéndola a pesar después luego de terminada. El cambio de masa observado por él fue de una pérdida 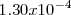 gramos (g) para una masa inicial de reacción de 170 g. Tan minúscula pérdida, inferior a una parte por millón, resultaba más pequeña que los errores de medida. Otros experimentos como ese tipo confirmaron más allá de toda duda la validez de la ley de la conservación de la masa (a).
gramos (g) para una masa inicial de reacción de 170 g. Tan minúscula pérdida, inferior a una parte por millón, resultaba más pequeña que los errores de medida. Otros experimentos como ese tipo confirmaron más allá de toda duda la validez de la ley de la conservación de la masa (a).
2.- Ley de las proporciones definidas
Enunciada por el químico francés Joseph Louis Proust (1754-1826). En la formación de un compuesto químico se observa que la cantidad de masa de un elemento que se combina con la masa determinada de otro es siempre la misma haciéndolo en proporciones constantes o definidas. Por ejemplo, dada una masa de sodio 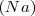 , la masa de cloro
, la masa de cloro 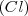 que hace falta para combinarse con ella y formar cloruro sódico
que hace falta para combinarse con ella y formar cloruro sódico 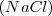 es siempre igual, sin que importe la cantidad inicial de cloro disponible en la mezcla de reacción. Así, se puede observar empíricamente que un 1.00 gramo (g) de sodio solo ”utiliza”, se combina con 1,54 g de cloro, aunque tenga a disposición 10 g en la mezcla de reacción.
es siempre igual, sin que importe la cantidad inicial de cloro disponible en la mezcla de reacción. Así, se puede observar empíricamente que un 1.00 gramo (g) de sodio solo ”utiliza”, se combina con 1,54 g de cloro, aunque tenga a disposición 10 g en la mezcla de reacción.
Otro ejemplo 100g de 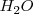 son siempre formadas a partir de 11.1 g de hidrógeno y 88.9 gr de oxígeno. La ratio de la masa de los reactivos es así
son siempre formadas a partir de 11.1 g de hidrógeno y 88.9 gr de oxígeno. La ratio de la masa de los reactivos es así 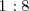 , cualquier muestra de agua contiene esa relación 1 parte de
, cualquier muestra de agua contiene esa relación 1 parte de 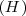 y 8 partes de
y 8 partes de 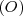 por masa. Por otra parte, 100 g de óxido de cobre
por masa. Por otra parte, 100 g de óxido de cobre 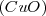 contienen 70.90 g
contienen 70.90 g 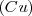 y 20.10 g de oxígeno con una relación masa de aproximadamente
y 20.10 g de oxígeno con una relación masa de aproximadamente 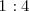 .
.
El hecho de que los elementos se combinen en proporciones fijas significa también que los cuerpos compuestos han de tener características definidas. Así por ejemplo el análisis del cloruro de sodio 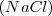 , obtenido por electrolisis de la sal fundida, indica que siempre obtenemos un 39 % de sodio y 61 % de cloro en masa. También tienen composición definida compuestos de más de dos elementos. El carbonato cálcico que se halla en la naturaleza como mineral calcita, consta de 40% de calcio (Ca), 12% de carbono (C) y 48% de oxigeno (O).
, obtenido por electrolisis de la sal fundida, indica que siempre obtenemos un 39 % de sodio y 61 % de cloro en masa. También tienen composición definida compuestos de más de dos elementos. El carbonato cálcico que se halla en la naturaleza como mineral calcita, consta de 40% de calcio (Ca), 12% de carbono (C) y 48% de oxigeno (O).
3.- Ley de las proporciones múltiples
Enunciada por el químico ingles John Dalton (1766-1844) después de la realización de un gran número de experimentos químicos de análisis cuantitativos y de síntesis de multitud de compuestos.
Esta ley establece que en una serie de compuestos entre los mismos elementos A y B, las masas de A combinadas con la unidad másica de B están en relaciones múltiples sencillas. Los elementos se pueden combinar en distintas maneras para formar distintas sustancias cuyas relación de masa están entre sí en relación de números enteros sencillos. Así, bajo condiciones diferentes, dos elementos dados pueden reaccionar originando distintos compuestos, los cuales mantienen siempre una relación de masa definida para una misma reacción pero pueden variar para reacciones diferentes.
Por ejemplo hay cinco diferentes tipos de óxidos de manganeso donde 100 g de manganeso 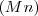 se combinan con 29.13 g , 43.69 g, 58.26 g, 87.38 g o 101.95 g de oxígeno
se combinan con 29.13 g , 43.69 g, 58.26 g, 87.38 g o 101.95 g de oxígeno 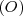 . Las diferentes cantidades de oxigeno en esos óxidos presentan las relación de masas de 2:3:4:6:7 que cumple la ley de proporciones o composición definidas. Por otra parte, las diferentes cantidades de oxigeno presentes en esos óxidos que se combina con la misma cantidad de
. Las diferentes cantidades de oxigeno en esos óxidos presentan las relación de masas de 2:3:4:6:7 que cumple la ley de proporciones o composición definidas. Por otra parte, las diferentes cantidades de oxigeno presentes en esos óxidos que se combina con la misma cantidad de 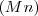 muestran una relación también de números enteros sencillos, en acuerdo con la ley de proporciones definidas. Otro ejemplo se pueden combinar 7g de
muestran una relación también de números enteros sencillos, en acuerdo con la ley de proporciones definidas. Otro ejemplo se pueden combinar 7g de 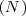 con 8 g de
con 8 g de 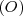 en una ratio de masa
en una ratio de masa 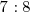 para formar óxido nítrico
para formar óxido nítrico 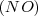 , o bien 7g de
, o bien 7g de 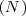 con 16 g de
con 16 g de 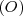 en una ratio de
en una ratio de 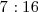 para dar otra sustancia conocida como óxido nitroso
para dar otra sustancia conocida como óxido nitroso 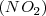 . Si comparamos entre si la relación de masas de Oxigeno que reaccionan presente en el math>(NO)</math> y el
. Si comparamos entre si la relación de masas de Oxigeno que reaccionan presente en el math>(NO)</math> y el 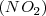 con una misma cantidad de nitrógeno tenemos que es igual a
con una misma cantidad de nitrógeno tenemos que es igual a 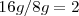 , cumpliéndose así la ley de las proporciones múltiples.
, cumpliéndose así la ley de las proporciones múltiples.
Teoría atómica de Dalton
Bibliografía
El pensamiento de los filósofos presocráticos puede encontrarse en:
Frederick Copleston. Historia de la Filosofía.Vol 1, Grecia y Roma. Editorial Ariel. 6ª Edición. 2001
G.S.Krik, J.E. Raven y M.Schofield. Los filósofos presocráticos. Editorial Gredos. 2ª Edición. 1987
El poema De Rerum Natura :
Lucrecio. De la naturaleza de las cosas. Biblioteca de Filosofía. Ediciones Folio S.A. 2002
(a) Información extraído del libro. Sienko, M.J. & Plane, R.A. Química. Ediciones Aguilar. 1973
Antonie Laurent De Lavoiser. Tratado de Química Elemental. Con introducción, traducción y Notas de Ramón Gago Bohórquez. Ediciones Alfaguara. 1982.Traducción en español de la edición original francesa Traité Eleméntaire de Chimie donde se expone la ley de la conservación de la masa.
Isaac Asimov. Breve Historia de la Química. Alianza Editorial. 1998. Un breve pero detallado relato de las historias de la química contada por probablemente uno de los mejores divulgadores científicos y escritor de ciencia ficción de la historia. Imprescindible. Disponible On-line en español en la página Web: [[3]]
Textos modernos de Química General :
En inglés: MacMurry,J & Robert F. C. Chemistry. Fourth Edition. Prentice Hall.2003
Peter Atkins. Principios De Química. Medica Panamericana. 2006.
Enlaces externos
En la Web de artículos históricos de química que se pueden encontrar en inglés: [[4]]
Entre ellos:
Extracto del libro “A New System of Chemical Phylosphy” de John Dalton [[5]]
El artículo de Prouts en inglés con la ley de proporciones definidas [[6]]
Tweet


