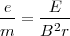Modelo atómico de Thomson
De Wikillerato
Tabla de contenidos |
Modelo atómico de Thomson
Experimento de Thomson
El científico inglés Sir Joseph John Thomson (1856-1940), conocido como “(J.J)” Thomson a finales del siglo XIX (entonces director del famoso laboratorio Cavendish de la Universidad de Cambridge), determinó de una manera directa la relación 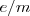 de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos.
de las partículas (corpúsculos) que componen los rayos catódicos sugiriendo además que esas partículas llamadas posteriormente electrones eran un constituyente fundamental de los átomos, cerrando con ello la controversia científica, mantenida en esa época sobre la naturaleza de los mismos.
El instrumento que J.J. Thomson empleó para determinar la relación carga-masa (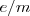 ) de los rayos catódicos es el precursor de los actuales tubos de televisión, del osciloscopio, de las pantallas de radar, etc.... El aparato consistía en un tubo de descarga de vidrio en el que se había hecho un vacío elevado, disponiendo en su interior de varios electrodos metálicos (cátodo, ánodo), dos ánodos de colimación (A1 y A2) que permiten generar un fino haz de rayos catódicos, los cuales son acelerados por la aplicación de un alto voltaje entre cátodo y el ánodo, pasando los mismos entre dos placas paralelas construidas en el tubo. La aplicación de un voltaje a esas placas produce un campo eléctrico (
) de los rayos catódicos es el precursor de los actuales tubos de televisión, del osciloscopio, de las pantallas de radar, etc.... El aparato consistía en un tubo de descarga de vidrio en el que se había hecho un vacío elevado, disponiendo en su interior de varios electrodos metálicos (cátodo, ánodo), dos ánodos de colimación (A1 y A2) que permiten generar un fino haz de rayos catódicos, los cuales son acelerados por la aplicación de un alto voltaje entre cátodo y el ánodo, pasando los mismos entre dos placas paralelas construidas en el tubo. La aplicación de un voltaje a esas placas produce un campo eléctrico (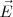 ) y con un imán se produce un campo magnético (
) y con un imán se produce un campo magnético (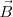 ) en dirección perpendicular al campo eléctrico; como veremos posteriormente este ordenamiento actúa como un selector de velocidad. Situada en el extremo opuesto del tubo se situaba una pantalla fluorescente de sulfuro de zinc, para detectar el punto de incidencia del haz de rayos catódicos, pudiendo medir con ello la desviación de su trayectoria rectilínea.
) en dirección perpendicular al campo eléctrico; como veremos posteriormente este ordenamiento actúa como un selector de velocidad. Situada en el extremo opuesto del tubo se situaba una pantalla fluorescente de sulfuro de zinc, para detectar el punto de incidencia del haz de rayos catódicos, pudiendo medir con ello la desviación de su trayectoria rectilínea.
Veamos como utilizando este aparato J.J. Thomson determinó experimental mente la relación carga-masa del electrón
Consideraciones teóricas previas
Cuando se aplica simultáneamente de manera perpendicular (i.e. con un águlo de 90º) un campo magnético 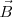 y un campo eléctrico
y un campo eléctrico 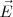 uniformes a una partícula cargada
uniformes a una partícula cargada  en movimiento con una velocidad
en movimiento con una velocidad  la fuerza total (llamada fuerza de Lorentz) que experimenta la carga
la fuerza total (llamada fuerza de Lorentz) que experimenta la carga 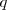 esta dada por ley de Lorentz, en forma vectorial:
esta dada por ley de Lorentz, en forma vectorial:
![(\vec F=q[\vec E+ (\vec v x \vec B)] (\vec F=q[\vec E+ (\vec v x \vec B)]](/images/math/math-7ca27fd2d8da11b039bf55fafcd1324c.png) [[1]]
[[1]]
con una componente de fuerza eléctrica y otra magnética.
La dirección de la fuerza magnética 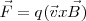 es perpendicular tanto a la dirección del campo magnético (
es perpendicular tanto a la dirección del campo magnético (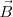 ) y a la velocidad (
) y a la velocidad (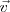 ), estando dada la magnitud de esta fuerza magnética por
), estando dada la magnitud de esta fuerza magnética por 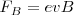 y bajo la acción de esta fuerza las partículas cargadas se mueven en una trayectoria circular de radio
y bajo la acción de esta fuerza las partículas cargadas se mueven en una trayectoria circular de radio  , dirigida perpendicularmente al campo (
, dirigida perpendicularmente al campo (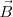 ), en una dirección completamente contraria y opuesta (i.e. hacia abajo) a la dirección (i.e hacia arriba, cuando la placa superior que produce el campo eléctrico es positiva) imprimida a la partícula cargada por la fuerza eléctrica
), en una dirección completamente contraria y opuesta (i.e. hacia abajo) a la dirección (i.e hacia arriba, cuando la placa superior que produce el campo eléctrico es positiva) imprimida a la partícula cargada por la fuerza eléctrica 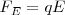 , lo esperable para una partícula cargada negativamente
, lo esperable para una partícula cargada negativamente  .
.
El radio  puede ser obtenido a partir de la segunda ley del movimiento de Newton (
puede ser obtenido a partir de la segunda ley del movimiento de Newton (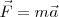 ) igualando la fuerza magnética
) igualando la fuerza magnética 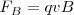 a m veces la aceleración centrípeta
a m veces la aceleración centrípeta 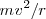 . La fuerza de magnética
. La fuerza de magnética 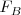 está dirigida hacia el centro del círculo.
está dirigida hacia el centro del círculo.
A partir de estas formulas el radio  se puede calcular.
se puede calcular.
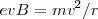
y así tenemos:
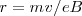
donde:
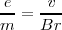
Donde  el radio de la curvatura y el valor
el radio de la curvatura y el valor 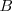 pueden ser medios y
pueden ser medios y  es una cantidad desconocida que hay que calcular.
es una cantidad desconocida que hay que calcular.
Determinación de la relación 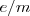
Por otra parte si se escogen las intensidades adecuadas de los dos campos (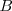 y
y 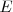 ), de forma que la relación de la magnitud de la fuerza eléctrica y magnética sean iguales tenemos que:
), de forma que la relación de la magnitud de la fuerza eléctrica y magnética sean iguales tenemos que:
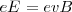
De la expresión encontramos que
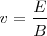
De esta manera se podía también encontrar la velocidad de las partículas, introduciendo el valor de intensidad del campo E y B, la cual solo dependerá del Voltaje (V) aplicado entre el cátodo y el ánodo según la relación (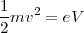 ); por lo que
); por lo que ![v=[2V(e/m)]^{1/2} v=[2V(e/m)]^{1/2}](/images/math/math-1d73d21616a7069ecead1dd91754123d.png)
Cuando se cumple la relación la partícula con carga 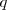 se mueve entonces en linea horizontal rectilínea a través de la región de los campos
se mueve entonces en linea horizontal rectilínea a través de la región de los campos 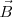 y
y 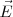 , por lo que inciden sobre la pantalla fluorescente situada al final del tubo, en el mismo punto que si no hubiera ningún campo eléctrico o magnético. De esta manera, solo las partículas que tengan una velocidad
, por lo que inciden sobre la pantalla fluorescente situada al final del tubo, en el mismo punto que si no hubiera ningún campo eléctrico o magnético. De esta manera, solo las partículas que tengan una velocidad  adecuada pasarán sin desviarse a través de los campos eléctricos y magnéticos orientados perpendicularmente. Si la fuerza magnética que se ejerce sobre las partículas que se mueven a velocidades más elevadas es mayor a la fuerza eléctrica, lo que desvía las partículas hacia arriba. Las que se mueven a velocidades menores se desvían hacia abajo. Por ello se dice que este ordenamiento de los campos
adecuada pasarán sin desviarse a través de los campos eléctricos y magnéticos orientados perpendicularmente. Si la fuerza magnética que se ejerce sobre las partículas que se mueven a velocidades más elevadas es mayor a la fuerza eléctrica, lo que desvía las partículas hacia arriba. Las que se mueven a velocidades menores se desvían hacia abajo. Por ello se dice que este ordenamiento de los campos 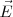 y
y 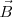 es un selector de velocidad , pues permite que las partículas cargadas se muevan a la misma velocidad durante la realización del experimento (un aspecto clave del mismo). Los valores de
es un selector de velocidad , pues permite que las partículas cargadas se muevan a la misma velocidad durante la realización del experimento (un aspecto clave del mismo). Los valores de  con los que Thompon operó en sus experimento de 1897, fueron del orden de
con los que Thompon operó en sus experimento de 1897, fueron del orden de 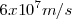 ; unas velocidades los suficientemente bajas como para no considerar los efectos relativistas, en aquel tiempo desconocidos.
; unas velocidades los suficientemente bajas como para no considerar los efectos relativistas, en aquel tiempo desconocidos.
Conociendo la velocidad de los rayos catódicos J.J. Thomson pudo determinar así la relación 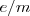 midiendo el desvío del haz producido cuando el campo magnético o el campo eléctrico actúa solo.
midiendo el desvío del haz producido cuando el campo magnético o el campo eléctrico actúa solo.
La relación 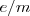 se puede calcular sustituyendo
se puede calcular sustituyendo 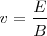 en la expresión
en la expresión 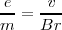 para obtener :
para obtener :
Ecuación que nos puede dar una medida directa de la relación 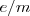 , ajustar el Voltímetro y el Amperimetro del aparato y introduciendo los valores de las medida de
, ajustar el Voltímetro y el Amperimetro del aparato y introduciendo los valores de las medida de  . El valor original obtenido para la relación
. El valor original obtenido para la relación 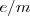 fue de aproximadamente
fue de aproximadamente 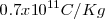 . Un poco por debajo del valor actual obtenido para
. Un poco por debajo del valor actual obtenido para 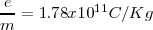 (en parte porque no había considerado el el campo magnético exterior de las región de las placas deflectoras). Thomson repitió el experimento de determinación
(en parte porque no había considerado el el campo magnético exterior de las región de las placas deflectoras). Thomson repitió el experimento de determinación 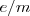 con diferentes gases en el tubo (aire, hidrógeno, dióxido de carbono, etc... ), y diferentes metales (cobre, hierro, plomo, plata, estaño o cinc) en el cátodo y siempre obtuvo el mismo valor de
con diferentes gases en el tubo (aire, hidrógeno, dióxido de carbono, etc... ), y diferentes metales (cobre, hierro, plomo, plata, estaño o cinc) en el cátodo y siempre obtuvo el mismo valor de 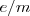 dentro de los valores de error experimental. Mostrando así que las partículas eran comunes a todos los metales.
dentro de los valores de error experimental. Mostrando así que las partículas eran comunes a todos los metales.
George Johnstone Stoney había acuñado el vocablo electrón en 1891 para designar la cantidad de electricidad que es capaz de depositar un gramo de hidrógeno en la electrolisis del agua. Según la ley de la electrólisis de Faraday, esa cantidad es aproximadamente 95.500 C/g, para explicar esta ley Stoney, supuso también la existencia de una carga elemental  de electricidad, que estaría asociada con cada átomo de hidrógeno. Bajo esta hipótesis entonces la ratio entre la carga e y la masa del átomo de hidrógeno
de electricidad, que estaría asociada con cada átomo de hidrógeno. Bajo esta hipótesis entonces la ratio entre la carga e y la masa del átomo de hidrógeno 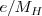 era de 95.500 C/g. Si la misma carga eléctrica está involucrada en ambos casos (en los rayos catódicos y en el fenómeno de la electrólisis), entonces la masa de de las partículas presentes en los rayos catódicos deben ser aproximadamente 1000 veces más pequeña que la masa del átomo de hidrógeno. Aunque ese valor fue posteriormente revisado y hoy conocemos la masa de las partículas de los rayos catódicos (el electrón) es (relación
era de 95.500 C/g. Si la misma carga eléctrica está involucrada en ambos casos (en los rayos catódicos y en el fenómeno de la electrólisis), entonces la masa de de las partículas presentes en los rayos catódicos deben ser aproximadamente 1000 veces más pequeña que la masa del átomo de hidrógeno. Aunque ese valor fue posteriormente revisado y hoy conocemos la masa de las partículas de los rayos catódicos (el electrón) es (relación 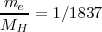 ) veces la del átomo del hidrógeno.
) veces la del átomo del hidrógeno.
En base a estos resultados experimentales, Thomson fue llevado a una conclusión inevitable,
En palabras de Thomson esta propuesta que en su tiempo fue audaz se puede leer en inglés como:
"I can see no escape from the conclusion that [cathode rays] are charges of negative electricity carried by particles of matter."
No puedo escapara la conclusión de que [los rayos catódicos] son cargas de electricidad negativa llevadas por partículas de materia
"What are these particles? are they atoms, or molecules, or matter in a still finer state of subdivision?"
Qué son estas partículas? Son átomos, o moléculas o materia en un estado más fino de subdivisión?.
"We have in the cathode rays matter in a new state, a state in which the subdivision of matter is carried very much further than in the ordinary gaseous state: a state in which all matter... is of one and the same kind; this matter being the substance from which all the chemical elements are built up."
Tenemos en los rayos catódicos materia en un nuevo estado, un estado en el cual la subdivisión de la materia es llevada más allá que la del estado ordinario gaseoso: un estado en el cual toda la materia...es de uno y una misma clase; esta materia es la sustancia a partir de la cual todos los elementos están construidos.
Las partículas recibieron el nombre de electrones de la mano del gran físico holandés Hendrik A. Lorentz que transfirió así este nombre el nombre propuesto por G. H. Stoney para una cantidad de electricidad fundamental a las partículas constituyentes de los rayos catódicos.
Los electrones constituían así la primera partícula subatómica fundamental en ser descubierta.
El átomo químico indivisible de Dalton empezaba a ser sustituido por un átomo físico que posee una estructura interna. La medida directa de la relación 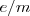 de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos.
de los electrones por J-J. Thomson en 1897 es considerado justamente el comienzo de la comprensión de la estructura atómica, situándose a partir de entonces el electrón como el componente atómico de mayor interés químico, básico para entender la naturaleza de la materia, de los átomos y las moléculas. Thomson recibió el premio Nobel en 1906 por sus trabajos.
El siguiente hito en el estudio del electrón fue la determinación cuantitativa de la masa (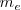 ) y la carga eléctrica
) y la carga eléctrica  portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano Robert. A. Millikan (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga
portada por el electrón. La cuantificación precisa de la carga del electrón fue realizada por el físico americano Robert. A. Millikan (1868-1953) en el famoso experimento de la gota de aceite, mostrando con ello que la carga del electrón viene dada en cantidades discretas de carga  .
.
Enlaces externos
Tubos de rayos catódicos, una página web dedicada a con la historia de estos aparatos: [[2]]
Artículo G.H. Stoney sobre el electrón: [[3]]
Artículo original de Thopmson: [[4]] Con el diagrama original de Thomson de su tubo de rayos catódicos:
Página dedicada al centenary del descubrimiento del electrón po J.J. Thomson [[5]]
Se pueden escuchar en las propias palabras (en inglés) su descubrimiento del electrón: [[6]]
Could anything at first sigth seem more impractical than a body which is so small that its mass is an insignificant fraction of the mass os an atom of hydrogen?
Podría algo a primera vista parecer tan impráctico como que un cuerpo sea así de pequeño que su masa es una fracción insignificante de la masa de un átomo de hidrógeno?
Tweet