Ley de Hess.Diagramas entálpicos
De Wikillerato
| Línea 21: | Línea 21: | ||
La ecuación termoquímica puede ser escrita como: | La ecuación termoquímica puede ser escrita como: | ||
| - | <math> 3H_2(g) + N_2(g) --> 2NH_3 (g) </math> <math> \Delta H^o \ = -92,2 kJ | + | <math> 3H_2(g) + N_2(g) --> 2NH_3 (g) </math> <math> \Delta H^o \ = -92,2 kJ </math> |
Si se miran los detalles de esta reacción , se encuentra que no es tan simple como aparece. De hecho el conunto de la reacción ocurre en una serie de etapas, con la hidrazina (<math> N_2H_4</math> producida en una etapa intermedia | Si se miran los detalles de esta reacción , se encuentra que no es tan simple como aparece. De hecho el conunto de la reacción ocurre en una serie de etapas, con la hidrazina (<math> N_2H_4</math> producida en una etapa intermedia | ||
| Línea 31: | Línea 31: | ||
Las ecuaciones termoquímicas de estas reacciones son: | Las ecuaciones termoquímicas de estas reacciones son: | ||
| - | Etapa 1: <math>2 H_2 (g) + N_2 (g) --> N_2H_4 (g) </math> <math>\Delta H^o =? </math> | + | Etapa 1: <math>2 H_2 (g) + N_2 (g) --> N_2H_4 (g) </math> <math>\Delta H^o = ? </math> |
Etapa 2: <math> N_2H_4 (g) + H_2 (g) --> 2NH_3 (g) </math> <math>\Delta H^o = -187,6 kJ) </math> | Etapa 2: <math> N_2H_4 (g) + H_2 (g) --> 2NH_3 (g) </math> <math>\Delta H^o = -187,6 kJ) </math> | ||
| Línea 37: | Línea 37: | ||
La reacción global: | La reacción global: | ||
| - | <math> 3H_2(g) + N_2(g)--> 2NH_3 (g) </math> | + | <math> 3H_2(g) + N_2(g)--> 2NH_3 (g) </math> <math> \Delta H^o = -92,2 kJ </math> |
Ya que según la ley de Hess: | Ya que según la ley de Hess: | ||
| Línea 72: | Línea 72: | ||
<math> FeCl_2(s) + 1/2Cl_2(g)--> FeCl_3(s) </math> <math> \Delta H_3\ = -57,7 kJ/mol) </math> | <math> FeCl_2(s) + 1/2Cl_2(g)--> FeCl_3(s) </math> <math> \Delta H_3\ = -57,7 kJ/mol) </math> | ||
| - | La ley de Hess resulta una herramienta fundamental para el cálculo de la entalpías de reacción, los valores tabulados de energías de formación, de energías de enlace, de calores de combustión, etc., combinados de distintas maneras, gracias al carácter sumatorio de las entalpías, nos permite calcular la entalpía de cualquier reacción que sea combinación de cualquiera de las anteriores. Por ello se hace innecesario tabular la entalpía de reacción de todas las reacciones químicas, solo una lista de aquellas a partir de las cuales otras reacciones pueden ser obtenidas con una apropiada combinación de reacciones. Las reacciones elegidas son las reacciones de formación de los compuestos a partir de sus elementos en el estado estándar. El estado estándar de un elemento se | + | La ley de Hess resulta una herramienta fundamental para el cálculo de la entalpías de reacción, los valores tabulados de energías de formación, de energías de enlace, de calores de combustión, etc., combinados de distintas maneras, gracias al carácter sumatorio de las entalpías, nos permite calcular la entalpía de cualquier reacción que sea combinación de cualquiera de las anteriores. Por ello se hace innecesario tabular la entalpía de reacción de todas las reacciones químicas, solo una lista de aquellas a partir de las cuales otras reacciones pueden ser obtenidas con una apropiada combinación de reacciones. Las reacciones elegidas son las reacciones de formación de los compuestos a partir de sus elementos en el estado estándar. El estado estándar de un elemento se considera el estado a presión y 25 ºC (298K). |
Condiciones de estado estándar: | Condiciones de estado estándar: | ||
| - | - Sólidos, líquidos y gases en forma pura a < | + | - Sólidos, líquidos y gases en forma pura a <math> 1 atm </math> de presión |
- Solutos a una concentración de <math>1 M </math> | - Solutos a una concentración de <math>1 M </math> | ||
Revisión de 11:16 29 jun 2010
Ley de Hess
Ley de Hess fue propuesta 1840 por el científico suizo-ruso Germain Henri Hess (1802-1850), es una consecuencia de la primera ley de la termodinámica (conservación de la energía) y de la independencia de los caminos en los cambios energéticos característica de las funciones de estado. Las variaciones entalpía como otra cualquier función de estado (e.g. energía interna, entropía), sólo depende de los estados inicial y final del sistema y no del camino recorrido.
La ley de Hess dice:
La variación de entalpía de una reacción química se puede expresar como suma algebraica de las variaciones entálpicas de otras reacciones químicas que dan lugar al mismo estado final.
O dicho de otro modo:
La variación de entalpía de una reacción química es igual a la suma algebraica de los cambios de entalpía de las etapas individuales de la reacción que dan lugar al mismo estado final.
Si un sistema pasa, por medio de una reacción química, de un estado a otro por dos caminos diferentes, una que requiere un solo paso y otro que se realiza a través de varias reacciones, aunque ambos llegan al mismo estado final, la entalpía de reacción por el primer camino debe ser a la suma de las entalpías de las reacciones del segundo camino.
Ejemplo:
El proceso Haber de producción industrial de amoniaco 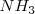 (utilizado principalmente como fertilizante). La reacción del hidrógeno con nitrógeno es exotérmica (
(utilizado principalmente como fertilizante). La reacción del hidrógeno con nitrógeno es exotérmica ( 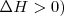 )
)
La ecuación termoquímica puede ser escrita como:
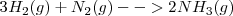
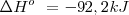
Si se miran los detalles de esta reacción , se encuentra que no es tan simple como aparece. De hecho el conunto de la reacción ocurre en una serie de etapas, con la hidrazina (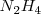 producida en una etapa intermedia
producida en una etapa intermedia
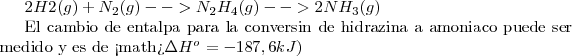 . Pero la medida del cambio
. Pero la medida del cambio 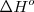 para la formación de hidrazina a partir del hidrógeno y nitrógeno no es tan fácil pues la reacción no es muy limpia. Algo de hidrazina se convierte en amoniaco pero algo del nitrógeno de partida permanece sin reaccionar. Sin embargo gracias a la ley de Hess el problema puede ser resuelto. La suma de la etapa 1 y la suma de la etapa 2 es igual al cambio total de entalpía de la reacción global.
para la formación de hidrazina a partir del hidrógeno y nitrógeno no es tan fácil pues la reacción no es muy limpia. Algo de hidrazina se convierte en amoniaco pero algo del nitrógeno de partida permanece sin reaccionar. Sin embargo gracias a la ley de Hess el problema puede ser resuelto. La suma de la etapa 1 y la suma de la etapa 2 es igual al cambio total de entalpía de la reacción global.
Las ecuaciones termoquímicas de estas reacciones son:
Etapa 1: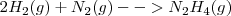
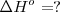
Etapa 2: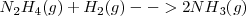
La reacción global:
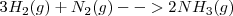
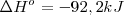
Ya que según la ley de Hess:
ΔHrO = ΔH1O + ΔH2O
Entonces reordenando la ecuación:
ΔH1O= ΔHrO - ΔH2O
ΔH1O=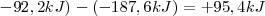
Esta ley se puede aplicar siempre que la magnitud que se quiera medir sea una función de estado (que dependa solo de los estado final e inicial y no del proceso de transformación). La ley de Hess, por tanto se puede enunciar de forma análoga para la variación de energía interna 
La ley de Hess nos permite calcular la variación de energía de gran cantidad de reacciones químicas, sin necesidad de medirla directamente, sólo conociendo los cambios energéticos de reacción que, combinados adecuadamente, dan lugar a la reacción deseada.
Un caso particularmente frecuente es aquél en el que conocemos las entalpías de formación de todos los compuestos que aparecen en una ecuación química. En ese caso, para calcular la variación de entalpía de la reacción, basta con sumar las entalpías de formación de los productos y restarles la suma de las entalpías de formación de los reactivos.
La entalpía normal para la reacción de tipo:
es:
Σ=ΔHmO (productos)- ΔnHmO(reactivos) = (c ΔHf, C O, + dΔHf, D O) - (a ΔHf, AO + bΔHf, BO)
Ejemplo:
La formación de 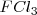 puede ser formado directamente a partir de hierro (
puede ser formado directamente a partir de hierro (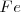 y
y 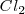 o a través de la formación de
o a través de la formación de 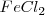 . El cambio de entalpía de ir de
. El cambio de entalpía de ir de 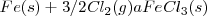 es la misma independiente de la ruta elegida (
es la misma independiente de la ruta elegida (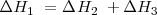 ).
).
Las ecuaciones termoquímicas de este proceso son:
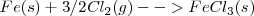
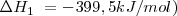
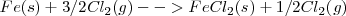
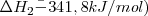
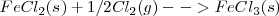
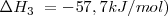
La ley de Hess resulta una herramienta fundamental para el cálculo de la entalpías de reacción, los valores tabulados de energías de formación, de energías de enlace, de calores de combustión, etc., combinados de distintas maneras, gracias al carácter sumatorio de las entalpías, nos permite calcular la entalpía de cualquier reacción que sea combinación de cualquiera de las anteriores. Por ello se hace innecesario tabular la entalpía de reacción de todas las reacciones químicas, solo una lista de aquellas a partir de las cuales otras reacciones pueden ser obtenidas con una apropiada combinación de reacciones. Las reacciones elegidas son las reacciones de formación de los compuestos a partir de sus elementos en el estado estándar. El estado estándar de un elemento se considera el estado a presión y 25 ºC (298K).
Condiciones de estado estándar:
- Sólidos, líquidos y gases en forma pura a 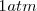 de presión
de presión
- Solutos a una concentración de 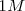
- A una temperatura de 25 ºC 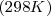
Diagramas entálpicos
Los cambios de entalpía pueden ser representados también en un diagrama entálpico.
Tweet


