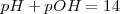El Producto iónico del agua. Concepto de pH
De Wikillerato
Ionización del agua
Una de las propiedades más importantes propiedades del agua es su capacidad para actuar como un ácido o como una base, i,e, de funcionar como una molécula anfiprótica (del griego anfi, ambos). Solo las moléculas o iones anfipróticos pueden sufrir autoprotolisis. En presencia de un ácido el agua actúa como base, mientras que en presencia de una base el agua actúa como un ácido. No es sorprendente por lo tanto que en agua pura una molécula pueda donar un protón a otra en una reacción el la cual el agua actúa tanto como ácido como base al mismo tiempo. Así, el agua pura se encuentra autoionizada (autoprotolisis) en una pequeñísima proporción según el proceso reversible:
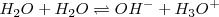
En una reacción de transferencia de un protón desde una molécula de agua otra; el ión oxonio 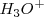 , cuando está solvatado (en disolución acuosa, hidratado) se llama ión hidronio
, cuando está solvatado (en disolución acuosa, hidratado) se llama ión hidronio 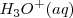 . La reacción se puede escribir de forma sencilla utilizando la concentración de iones hidrógeno
. La reacción se puede escribir de forma sencilla utilizando la concentración de iones hidrógeno 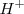
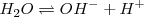
La constante de equilibrio para este equilibrio químico a una determinada temperatura es:
![K_c= \frac{ [OH]^{-} [H]^{+} }{[H_2O]}} K_c= \frac{ [OH]^{-} [H]^{+} }{[H_2O]}}](/images/math/math-260d0e7d535e7b134a44ddc5382bd7e2.png)
Teniendo en cuenta que la concentración molar del agua pura es ![[H_2O] =55.5 M (moles/litro) [H_2O] =55.5 M (moles/litro)](/images/math/math-017d0225a5faa7014612eeba1218c71c.png) (calculada a partir de su densidad y masa molar
(calculada a partir de su densidad y masa molar ![[H_2O]= (1000 g/L) (1mol/18.0 g) =55.5 M, mol/L [H_2O]= (1000 g/L) (1mol/18.0 g) =55.5 M, mol/L](/images/math/math-37073a1bc5a8c02a982f306b8114bbf0.png) , mientras que la concentración de iones hidrógeno, a la temperatura estándar de
, mientras que la concentración de iones hidrógeno, a la temperatura estándar de 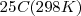 es solo de
es solo de 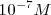 , es decir una cantidad despreciable frente a 55.5 M se puede considerar que la molaridad del agua es una constante que puede ser incorporada en una constante “mayor” que incluya también a
, es decir una cantidad despreciable frente a 55.5 M se puede considerar que la molaridad del agua es una constante que puede ser incorporada en una constante “mayor” que incluya también a 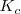 y que es conocida como producto iónico del agua,
y que es conocida como producto iónico del agua, ![K_w=K_c[H_2O] K_w=K_c[H_2O]](/images/math/math-98eb75f7c9f11ace3ea7128734bb7fbf.png) . El valor de
. El valor de 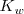 (el subíndice
(el subíndice 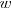 proviene de water palabra en inglés que significa agua) se calcula teniendo en cuenta que las mediadas experimentales de la extensión de la disociación de las moléculas de agua las cuales muestran que la concentración de
proviene de water palabra en inglés que significa agua) se calcula teniendo en cuenta que las mediadas experimentales de la extensión de la disociación de las moléculas de agua las cuales muestran que la concentración de 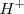 (en forma de iones hidronio) en agua pura es de
(en forma de iones hidronio) en agua pura es de 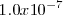 M a 25 ºC. Ya que la reacción de disociación del agua produce igual concentración de iones
M a 25 ºC. Ya que la reacción de disociación del agua produce igual concentración de iones 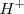 que iones hidroxilo
que iones hidroxilo 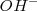 la concentración molar de
la concentración molar de 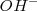 en agua pura será también de
en agua pura será también de 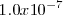 a 25 ºC. Esto es:
a 25 ºC. Esto es:
![[H^+]=[OH^-] = 1.0 x 10^{-7} M [H^+]=[OH^-] = 1.0 x 10^{-7} M](/images/math/math-8e2a34935228ff5b7359886e0e98de26.png) a 25 ºC
a 25 ºC
Luego:
Producto iónico del agua
Este valor se mantiene constante, siempre que la temperatura sea de 25 ºC , no importa que otras sustancias estén presentes en la disolución.
La relación entre las moléculas de agua disociadas frente a las no disociadas es aproximadamente de 2 a 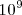 , un número muy pequeño:
, un número muy pequeño:
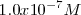 /
/ 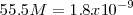
Hay dos aspectos importantes en la dinámica del equilibrio de la disociación del agua. Primero, las reacciones directa y reversa son rápidas; las moléculas de 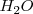 , iones
, iones 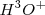 y
y 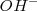 se interconvierten rapidamente por transferencia protónica de una especie a otra. Segundo la posición del equilibrio está desplazado hacia la izquierda de la ecuación según está escrita, en cualquier instante dado solo una pequeña fracción de las moléculas de agua están disociadas en
se interconvierten rapidamente por transferencia protónica de una especie a otra. Segundo la posición del equilibrio está desplazado hacia la izquierda de la ecuación según está escrita, en cualquier instante dado solo una pequeña fracción de las moléculas de agua están disociadas en 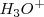 y
y 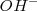 . La vasta mayoría de las moléculas de agua están sin disociar.
. La vasta mayoría de las moléculas de agua están sin disociar.
Así se puede distinguir las soluciones acuosas como ácidas, neutras y básicas por los valores relativos de la concentración de iones (oxonio) hidronios 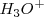 y iones hidroxilo
y iones hidroxilo 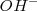 , esto es:
, esto es:
Ácida:![[H_3O^+]> [OH^-] [H_3O^+]> [OH^-]](/images/math/math-1aed728ce4db30b55a9b7e629aff6ba4.png)
Neutra:![[H_3O^+]= [OH^-] [H_3O^+]= [OH^-]](/images/math/math-c46d350e25eef657a6c5912a8d460d09.png)
Básica:![[H_3O^+]< [OH^-] [H_3O^+]< [OH^-]](/images/math/math-2608a4fd5f951035452715945ea73354.png)
Una disolución se considera neutra cuando ![[H^+]= 10^{-7} [H^+]= 10^{-7}](/images/math/math-c05f36a627551e41308141c1cdc244b0.png) ; ácida cuando
; ácida cuando ![[H^+] > 10^{-7} [H^+] > 10^{-7}](/images/math/math-e267e84524b12aafd7fa12aa1a61087b.png) y básica cuando la
y básica cuando la ![[H^+] < 10^{-7} [H^+] < 10^{-7}](/images/math/math-ea9ae4adaa313da7f00ffaa2ed719095.png) . Por otra parte las correspondientes concentraciones del ión hidróxido
. Por otra parte las correspondientes concentraciones del ión hidróxido 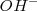 se pueden calcular fácilmente mediante el producto iónico del agua.
se pueden calcular fácilmente mediante el producto iónico del agua.
Concepto y escala de pH
La acidez de una disolución está determinada por la concentración de iones hidronios 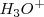 . Pero las concentraciones de iones hidronios en las disoluciones pueden cubrir un intervalo enorme. Desde una disolución de 1M de
. Pero las concentraciones de iones hidronios en las disoluciones pueden cubrir un intervalo enorme. Desde una disolución de 1M de 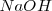 hasta otra de 1M de
hasta otra de 1M de 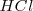 , la variación es de uno a cien billones. Por otra parte, se trata de números muy pequeños que tiene que ser expresados como potencias negativas de 10, de manejo poco práctico.
, la variación es de uno a cien billones. Por otra parte, se trata de números muy pequeños que tiene que ser expresados como potencias negativas de 10, de manejo poco práctico.
Con el fin de expresar estas concentraciones de una forma más sencilla que evitase manejar potencias negativas, el químico danés S.P. L. Sörensen (1868-1939) introdujo en 1909 el concepto de 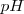 que se define como el logaritmo decimal cambiado de la concentración de iones hidrónio:
que se define como el logaritmo decimal cambiado de la concentración de iones hidrónio:
o expresado simplemete:
El símbolo 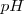 proviene de la expresión francesa puissance d’hydrogène ( “potencial de hidrógeno”) , puesto que el
proviene de la expresión francesa puissance d’hydrogène ( “potencial de hidrógeno”) , puesto que el 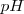 es función lineal del potencial electroquímico de la disolución medido a través de un electrodo especial llamado electrodo de hidrógeno.
es función lineal del potencial electroquímico de la disolución medido a través de un electrodo especial llamado electrodo de hidrógeno.
Es evidente que la definición se puede deducir fácilmente que la igualdad
![[H_3O^+]= antilog (-pH)=10^{-pH} [H_3O^+]= antilog (-pH)=10^{-pH}](/images/math/math-9cc319d65b4988d6931bc79dd7a58922.png)
Así una disolución será:
Neutra cuando su 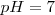
Esto es 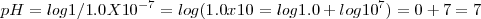
Ácida cuando sea inferior a 7, 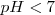
Básica cuando sea superior a 7. 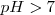
Debido a que la escala de pH es logarítmica (no aritmética) el pH cambia en una unidad cuando la concentración de ![[H_3O^+] [H_3O^+]](/images/math/math-c67380778ea9c73d71ca24673166d185.png) cambia por un factor de 10, por 2 unidades cuando de
cambia por un factor de 10, por 2 unidades cuando de ![[H_3O^+] [H_3O^+]](/images/math/math-c67380778ea9c73d71ca24673166d185.png) cambia por un factor de 100, y por 6 unidades cuando la concentración de
cambia por un factor de 100, y por 6 unidades cuando la concentración de ![[H_3O^+] cambia por un factor de 100000. Se puede apreciar la compresión que la escala de pH realiza de la concentración <math> H_3O^+ [H_3O^+] cambia por un factor de 100000. Se puede apreciar la compresión que la escala de pH realiza de la concentración <math> H_3O^+](/images/math/math-705188aa194cb6d6cfbf446ea95dbf39.png) comparando las cantidades de ácido clorhídrico
comparando las cantidades de ácido clorhídrico 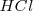 necesario para cambiar el pH de una piscina. Se necesitaría solo 100 ml de una solución de
necesario para cambiar el pH de una piscina. Se necesitaría solo 100 ml de una solución de 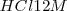 para cambiar el pH del agua de la piscina de 7 a 6, pero se necesitarían 10000 litros de esa misma solución para cambiar el pH de la piscina 7 a 1.
para cambiar el pH del agua de la piscina de 7 a 6, pero se necesitarían 10000 litros de esa misma solución para cambiar el pH de la piscina 7 a 1.
Para que tenga un valor práctico, la escala ordinaria de pH se establece convencionalmente en un extremo muy básico representado por una disolución de ¡M de hidróaxido sódico 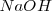 , al que correspondería un
, al que correspondería un 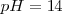 , y un extremo muy ácido ejemplificado en una disolución de 1M de ácido clorhídrico
, y un extremo muy ácido ejemplificado en una disolución de 1M de ácido clorhídrico 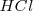 , cuyo
, cuyo 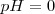
Análogamente se define el 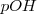 como
como ![pOH=-log[OH^- ] pOH=-log[OH^- ]](/images/math/math-5d79a309787011a6249729f1a2f3310d.png)
Si se toman logaritmos en los dos miembros del producto iónico del agua, se llega a la relación:
Una importante relación que ayuda bastante en los cálculos sobre problemas de sistemas ácido-base.
Tweet

![pH= -log [H_3O^+] pH= -log [H_3O^+]](/images/math/math-abcb234ce614cbb086710312f6cc49cd.png)
![pH=-log [H^+] pH=-log [H^+]](/images/math/math-5eb382a0290407ea6af6c2aaceaffa93.png)